(12分) 照相用的废定影液中含有Na+、[Ag(S2O3)2]3-、Br-等离子。某研究性学习小组拟通过下列实验程序,对某照相公司的废定影液进行实验处理,回收其中的银和溴。
(已知:4H++2 [Ag(S2O3)2]3-= Ag2S↓+3S↓+3SO2 ↑+SO42-+2H2O)
↑+SO42-+2H2O)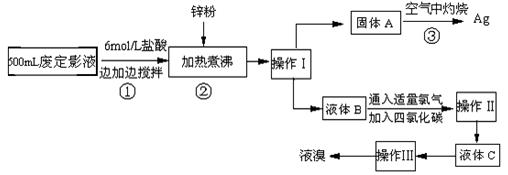
(1)操作Ⅲ的名称是 ▲ ;操作Ⅱ需要的主要玻璃仪器有 ▲ 。
(2)加入锌粉的目的是将少量溴化银中的银还原出来,该反应的离子反应方程式为 ▲。
(3)液体B中除含有Br-,还有SO42-,检验溶液中存在SO42-的操作是 ▲ 。
(4)步骤③实验操作时,也常采用加入适量硝酸钾加盖后再灼热的方法,推测加硝酸钾的目的可能是 ▲ 。
(5)通过上述回收银的流程中,从绿色化学的要求看,存在的不足为 ▲ 。
氯气是一种重要的工业原料。
(1)实验室可用二氧化锰和浓盐酸反应制取氯气,反应的化学方程式是
。
(2)资料显 示:Ca(ClO)2 +CaCl2+2H2SO4
示:Ca(ClO)2 +CaCl2+2H2SO4 2CaSO4+2Cl2↑+2H2O。某学习小组利用此原理设计如图所示装置制取氯气并探究其性质。
2CaSO4+2Cl2↑+2H2O。某学习小组利用此原理设计如图所示装置制取氯气并探究其性质。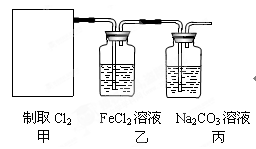
①在该实验中,甲部分的装置是(填字母)。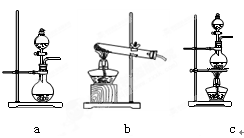
②乙装置中FeCl2溶液与Cl2反应的离子方程式是 。
。
证明FeCl2与Cl2发生了氧化还原反应的实验方法是。
③丙装置中通入少量Cl2,可制得某种生活中常用的漂白、消毒的物质。已知碳酸的酸性强于次氯酸,则丙中发生反应的化学方程式是。
④该实验存在明显的缺陷,改进的方法是 。
。
(3)为测定漂白粉中Ca(ClO)2的质量分数,该小组将2 g漂白粉配制成250 mL溶液,取出25 mL并向其中依次加入过量稀H2SO4、过量KI溶液,完全反应后,再滴入0.1 mol/L Na2S2O3溶液:2Na2 S2O3+I2 ="==" Na2S4O6+2NaI,共消耗20 mL Na2S2O3,则漂白粉中Ca(ClO)2的质量分数为。
S2O3+I2 ="==" Na2S4O6+2NaI,共消耗20 mL Na2S2O3,则漂白粉中Ca(ClO)2的质量分数为。
某研究性学习小组用如下图装置进行铜与浓硫酸反应的实验研究。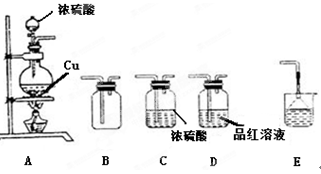
(1)装置A中发生反应的化学方程式;
(2)若要使B 中收集满干燥的SO2气体(并证实B中已收集满),则上述装置的连接顺序为:接接接接(用字母表示)
(3)待烧瓶中充分反应后,同学们发现铜有剩余。经检测发现硫酸也有剩余.其原因是;
检验硫酸有剩余的方法是.
(4)在不补充浓硫酸的前提下.为使铜进一步溶解,可向烧瓶中加入(填序号)
①盐酸② FeSO4③ Fe2O3④KNO3
黄铁矿的主要成分是FeS2。测定黄铁矿中FeS2含量的两种方法如下图所示: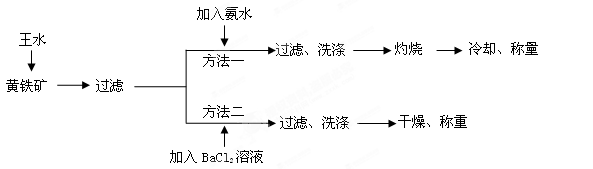
已知:
①王水是由1体积的浓硝酸(ρ=1.42g·cm-3)和3体积的浓盐酸(ρ=1.19g·cm-3)混合而成的。
②黄铁矿和王水反应的方程式为FeS2+5HNO3+3HCl=FeCl3+2H2SO4+5NO↑+2H2O
请回答下列问题:
(1)简述实验室配制王水的操作过程_____________________________________
(2)方法一中过滤、洗涤、灼烧都用到的仪器是_______________。
(3)方法二中要判断BaCl2溶液是否过量,可向滤液中加入X溶液,X可以是____(填代号)
| A.NaOH | B.BaCl2 | C.HCl | D.Na2SO4 |
(4)实验室利用下列装置和试剂制取少量氯化氢气体
试剂:①浓硫酸 ②浓盐酸 ③食盐固体 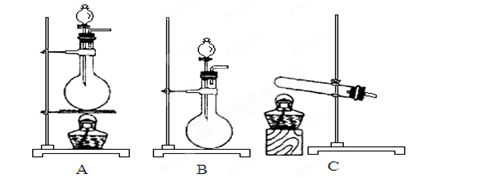
若选用试剂①②,则宜选择的装置是____________。
若选用试剂①③,则应选择的装置是___________(填代号,下同);推测发生反应的化学方程式为__________________________________________________;
(5)方法一中,灼烧时发生反应的化学反应方程式为________________________ ;已知称取黄铁矿样品的质量为1.50g,称得灼烧后固体的质量为0.4g,不考虑操作误差,则该矿石中FeS2的质量分数是________________。
.某课外活动小组学生模拟呼吸面具中的原理(过氧化钠与潮湿二氧化碳反应),设计用下图所示的仪器来制取氧气并测量氧气的体积上图中量气装置E是由甲、乙两根玻璃管组成,它们用橡皮管连通,并装入适量水。甲管有刻度(0~50mL),供量气用;乙管可上下移动,以调节液面高低。
实验室可供选用的药品还有:稀硫酸、盐酸、过氧化钠、碳酸钠、大理石、水
试回答:(1)上述装置的连接顺序是(填各接口的编号,其中连接胶管及夹持装置均省略):___________。
(2)装置C中放入的反应物是__________和__________。
(3)装置A的作用是__________,装置B的作用是__________。
(4)为了较准确地测量氧气的体积,除了必须检查整个装置的气密性之外,在读取反应前后甲管中液面的读数,求其差值的过程中,应注意____________和____________(填写字母编号)。
a.视线与凹液面最低数相平
b.等待片刻,待乙管中液面不再上升时,立刻读数
c.读数时应上下移动乙管,使甲、乙两管液面相平
d.读数时不一定使甲、乙管液面相平
(17分)实验室中有三瓶失去标签的酸,分别是浓硫酸、浓盐酸和浓硝酸。
(1)有同学认为,用金属铜做试剂可鉴别上述三种酸,请用化学方程式和必要的文字加以说明。____________________________________________________________________。
(2)请设计一个实验装置,使铜与稀硫酸反应生成硫酸铜与氢气。在下面的方框内画出装置图,并标明电极材料名称和电解质溶液名称。
(3)实验室中欲用浓硫酸配制2.0mol·L-1的稀硫酸500mL。
①实验过程中所需仪器除了量筒、烧杯、玻璃棒外,还需要的仪器有____________________;
②下列操作中造成所配溶液浓度偏低的是_____________。
a.用量筒量取浓硫酸时仰视刻度线
b.定容时俯视刻度线
c.转移溶液后未洗涤烧杯和玻璃棒就直接定容
d.定容后摇匀,发现液面低于刻度,未补加蒸馏水至刻度
(4)下图所示为实验室模拟工业上利用氨催化氧化法制备硝酸的实验
用装置A制备干燥氨气,装置B制备干燥氧气。
①装置A的试管中发生反应的化学方程式为_______________________________。
装置B的烧瓶内发生反应的化学方程式为__________________________________。
②下列关于A、B装置的叙述不正确的是__________
a.若选择合适的试剂,用B装置也可制备氨气
b.实验过程中,A、B装置中一定有一个发生氧化还原反应
c.U形管中的试剂可以相同,但作用不相同
③按照a接c,b接d的顺序连接装置进行实验。
玻璃管内发生反应的化学方程式为___________________________________。
实验结束后,某同学测得装置C中试管内所得溶液的pH<7,得出的结论为该溶液一定是硝酸。该结论__________(填“严密”或“不严密”),你的理由是_____________________________。