金属钛(Ti)性能优越,被称为继铁、铝之后的“第三金属”。工业上以金红石为原料制取Ti的反应:
aTiO2 + bCl2 + cC 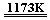 aTiCl4 + cCO ……反应①
aTiCl4 + cCO ……反应①
TiCl4 +2Mg 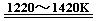 Ti + 2MgCl2 ……反应②
Ti + 2MgCl2 ……反应②
关于反应①、②的分析不正确的是
① TiCl4在反应①中是还原产物,在反应②中是氧化剂;② C、Mg在反应中均为还原剂,被还原;③ 在反应①、②中Mg的还原性大于Ti,C的还原性大于TiCl4;④a=1,b=c=2;⑤ 每生成19.2 g Ti,反应①、②中共转移4.8 mol e-。
A.①②④ B.②③④ C.③④ D.②⑤
普通干电池的电极分别为碳棒和锌筒,以糊状NH4Cl和ZnCl2作电解质(其中加入MnO2吸收H2,ZnCl2吸收NH3),电极反应可简化为:Zn-2e-=Zn2+,2NH4++2e-= 2NH3+H2。根据以上所述判断下列结论不正确的是
| A.工作时Zn为负极,发生还原反应 |
| B.工作时电流由碳极经外电路流向Zn极 |
| C.输出电流时碳棒上发生还原反应 |
| D.长时间使用后内装糊状物可能流出,腐蚀用电器 |
某条件下在密闭容器中发生反应X2 + 3Y2 2Z2,下图是反应过程中,反应速率(v)与时间(t)的关系曲线,下列叙述正确的是
2Z2,下图是反应过程中,反应速率(v)与时间(t)的关系曲线,下列叙述正确的是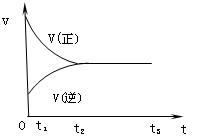
| A.0~t1时,X2、Y2、Z2的物质的量浓度由于反应进行而减小 |
| B.t2~t3时,反应体系中Y2的浓度没有变化 |
| C.到t3以后,反应已达限度,不管如何改变条件,反应不再进行 |
| D.从关系曲线可知,反应开始时体系中只有X2和Y2 |
根据下图提供的信息,下列所得结论正确的是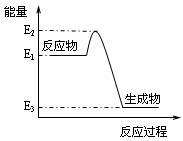
| A.该反应是吸热反应 |
| B.该反应的生成物比反应物稳定 |
| C.该反应一定可以设计成为原电池 |
| D.该反应向外界放出的热量为E2-E3 |
下列说法或表示方法不正确的是
| A.燃料的燃烧反应都是放热反应 |
| B.绿色植物进行光合作用时,能把光能转化为化学能 |
| C.分子的热稳定性主要取决于分子内化学键的键能大小,与分子间作用力无关 |
D.已知:N2(g)+3H2(g) 2NH3(g) △H="-92.4" kJ·mol-1,则说明相同条件下,在密闭容器中,1 mol N2和3 mol H2混合充分反应后放热92.4 kJ 2NH3(g) △H="-92.4" kJ·mol-1,则说明相同条件下,在密闭容器中,1 mol N2和3 mol H2混合充分反应后放热92.4 kJ |
同一主族的两种元素的原子序数之差不可能是
| A.6 | B.16 | C.26 | D.36 |