用锌片与稀硫酸反应制氢气时,下列措施不能使氢气生成速率加大的是
| A.加热 | B.不用稀硫酸,改用98%浓硫酸 |
| C.用粗锌代替纯锌 | D.不用锌片,改用锌粉 |
反应mA(s)+nB(g) pC(g) ΔH<0,在一定温度下,平衡时B的体积分数(B%)与压强变化的关系如图所示,下列叙述中一定正确的是()
pC(g) ΔH<0,在一定温度下,平衡时B的体积分数(B%)与压强变化的关系如图所示,下列叙述中一定正确的是()
①m+n>p ②x点表示的正反应速率大于逆反应速率 ③x点比y点时的反应速率慢 ④n>p ⑤若升高温度,该反应的平衡常数增大
| A.①②⑤ | B.只有②④ | C.只有②③ | D.①③⑤ |
高氯酸、硫酸、硝酸和盐酸都是强酸,其酸性在水溶液中差别不大.以下是某温度下这四种酸在冰醋酸中的电离常数
| 酸 |
HClO4 |
H2SO4 |
HCl |
HNO3 |
| Ka |
1.6×10-5 |
6.3×10-9 |
1.6×10-9 |
4.2×10-10 |
从以上表格中判断以下说法中不正确的是()
A.在冰醋酸中这四种酸都没有完全电离
B.在冰醋酸中高氯酸是这四种酸中最强的酸
C.在冰醋酸中硫酸的电离方程式为H2SO4=2H++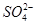
D.水对于这四种酸的强弱没有区分能力,但醋酸可以区别这四种酸的强弱
已知:①C(s) +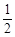 O2(g)
O2(g) CO(g);△H =" –" 110.5 kJ · mol – 1
②C(s) + O2(g) CO2(g);△H =" –" 393.51 kJ · mol – 1
则反应:C(s) + CO2(g) 2CO(g)的△H为( )
| A.– 283.01 kJ · mol – 1 | B.+ 172.51 kJ · mol – 1 |
| C.+ 283.01 kJ · mol – 1 | D.+ 504.00 kJ · mol – 1 |
在一定温度下,向a L密闭容器中加入1mol X气体和2 mol Y气体,发生如下反应:
X(g)+2Y(g)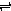 2Z(g), 不能标志该反应达平衡状态的是( )
2Z(g), 不能标志该反应达平衡状态的是( )
| A.容器内压强不随时间变化 | B.容器内各物质的浓度不随时间变化 |
| C.容器内X、Y、Z的浓度之比为1︰2︰2 | D.X的生成速率和Z的生成速率之比为1︰2 |
20℃时H2S饱和溶液1 L,其浓度为0.1 mol / L,若要使溶液的pH和c(S2-)减小,可采取的措施是()
| A.加入适量的CuSO4固体 | B.加入少量的氢氧化钠固体 |
| C.通入适量的H2S气体 | D.加入适量水 |