将 4 mol A 气体和 2 mol B 气体在 2 L 的定容容器中混合并在一定条件下发生如下反应 : ;经 2 s后测得 C 的物质的量浓度为 0.6 mol·L-1,现有下列几种说法:
;经 2 s后测得 C 的物质的量浓度为 0.6 mol·L-1,现有下列几种说法:
① 用物质 A 表示的这段时间的平均速率为 0.3 mol·L-1·s-1
② 用物质 B 表示的这段时间的平均速率为 0.6 mol·L-1·s-1
③ 2 s 时物质 A 的转化率为30%
④ 2 s 时物质 B 的物质的量浓度为 0.3mol·L-1
其中正确的是
| A.①③ | B.②④ | C.①② | D.③④ |
A、B、C、D四种物质间能够实现下列转化,不符合转化关系的A物质是()
A.硅B.硫C.钠D.氯气
同位素示踪法可用于反应机理的研究,下列反应或转化中同位素示踪表示正确的是( )
| A.2Na218O2 + 2H2O ="=" 4Nal8OH + O2↑ |
B.NH4Cl + 2H2O NH3·2H2O + HCl NH3·2H2O + HCl |
| C.2KMnO4 + 5H218O2 + 3H2SO4 ="=" K2SO4 + 2MnSO4 + 518O2↑+ 8H2O |
| D.K37ClO3 + 6HCl ="=" K37Cl + 3Cl2↑+ 3H2O |
已知:2KMnO4+16HCl==2KCl+2MnCl2+5Cl2↑+8H2O,K2Cr2O7+14HCl==2KCl+2CrCl3+3Cl2↑+7H2O,MnO2+4HCl MnCl2+Cl2↑+2H2O ,
MnCl2+Cl2↑+2H2O ,
其中,KMnO4和一般浓度的盐酸即可反应,K2Cr2O7需和较浓盐酸(>6mol/L)反应,MnO2需和浓盐酸(>8mol/L)反应。根据以上信息,下列结论中不正确的是()
| A.上述反应既属于氧化还原反应,又属于离子反应 |
| B.生成1molCl2转移电子数均为2NA |
| C.盐酸浓度越大,Cl—的还原性越强 |
| D.氧化性:KMnO4 >K2Cr2O7> Cl2> MnO2 |
下列关于各实验装置图的叙述中,正确的是()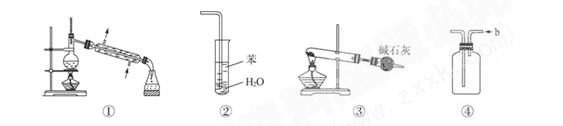
| A.装置①常用于分离互不相溶的液体混合物 |
| B.装置②可用于吸收NH3,并防止倒吸 |
| C.以NH4HCO3为原料,装置③可用于实验室制备少量NH3 |
| D.装置④b口进气可收集Cl2、NO等气体 |
下列解释原理的表达式中,不正确的是()
A.镁的冶炼: 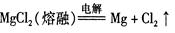 |
B.用热的纯碱溶液清洗油污: |
C.用Na2CO3溶液处理水垢中的CaSO4: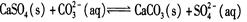 |
D.用氢氟酸刻蚀玻 璃:4HF+SiO2=SiF4↑+2H2O 璃:4HF+SiO2=SiF4↑+2H2O |