如图所示原电池装置中,电解质溶液为硫酸,下列有关叙述错误的是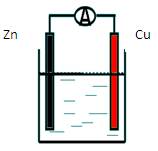
| A.锌做负极发生氧化反应 |
| B.供电时的总反应为:Zn + H+ = Zn2+ + H2 |
| C.该装置可实现化学能转化为电能 |
| D.产生1molH2,消耗锌的质量32.5g |
下列离子方程式书写正确的是
| A.铜屑中加入足量氯化铁溶液:Fe3++ Cu= Fe2++ Cu2+ |
| B.大理石中加入足量浓盐酸:CaCO3+2H+=Ca2++CO2↑+H2O |
| C.硫酸溶液中加入足量氢氧化钡溶液:Ba2++OH-+H++SO42-=BaSO4↓+H2O |
| D.碳酸氢铵溶液中加入足量氢氧化钠溶液:HCO3-+OH-=CO32-+H2O |
下图为完成不同的化学实验所选用的装置或进行的操作,其中正确的是
| A.装置①可用于分离互不相溶的液体 |
| B.装置②可用于实验室配置一定物质的量浓度溶液 |
| C.装置③可用于验证醋酸、碳酸、苯酚的酸性强弱 |
| D.装置④可用于实验室制备少量氨气 |
下列各组离子在制定的溶液中一定能大量共存的是
| A.无色溶液:K+、Al3+、NO3-、AlO2- |
| B.pH=12的溶液:K+、Cl-、SO32- 、SiO32- |
| C.含0.1mol•L-1 NO3-的溶液:H+、Fe3+、Cl-、SO42- |
| D.由水电离产生的c(H+)=1×10-12 mol•L—1的溶液:Na+、NH4+、SO42-、HCO3- |
已知Zn(s)+ H2SO4(aq)= ZnSO4(aq)+ H2(g) ΔH<0;则下列叙述不正确的是
| A.该反应的ΔH值与反应物用量无关 |
| B.该反应的化学能可以转化为电能 |
| C.反应物的总能量高于生成物的总能量 |
| D.该反应中反应物的化学键断裂放出能量,生成物化学键形成吸收能量 |
能实现下列物质件直接转化的元素是
| A.硅 | B.氮 | C.钠 | D.铁 |