同分异构现象在有机化合物中是非常普遍的。下列各组化合物中互为同分异构体的是
①CH3CH2CH2CH3和(CH3)2CHCH3; ②CH3CH2OH和CH3CH2CH2OH;
③CH3COOCH2CH3和CH3CH2CH2COOH;
④CH3CH=CHCH3和CH3CH2CH=CH2;
⑤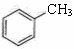 和
和
| A.①②④ | B.①③⑤ | C.①③④⑤ | D.①③④ |
下列实验操作不能达到实验的是( )
|
选项 |
A |
B |
C |
D |
|
目的 |
检验 氯丁烷中氯元素 |
检验 是否沉淀完全 |
制备检验醛基用的 |
制备晶体 |
|
操作 |
|
|
|
|
| A. |
A |
B. |
B |
C. |
C |
D. |
D |
(多选)近年来,我国航天科技事业取得了辉煌的成就。下列说法错误的是( )
| A. |
我国科学家由嫦娥五号带回的月壤样品中,首次发现了天然玻璃纤维,该纤维中的主要氧化物 属于离子晶体 |
| B. |
某型长征运载火箭以液氧和煤油为推进剂,液氧分子间靠范德华力凝聚在一起 |
| C. |
“嫦娥石” 是我国科学家首次在月壤中发现的新型静态矿物,该矿物中的 位于周期表中的 区 |
| D. |
航天员出舱服中应用了碳纤维增强复合材料。碳纤维中碳原子杂化轨道类型是 |
(多选)实践中一些反应器内壁的污垢,可选用针对性的试剂溶解除去。下表中污垢处理试剂的选用,符合安全环保理念的是( )
|
选项 |
A |
B |
C |
D |
|
污垢 |
银镜反应的银垢 |
石化设备内的硫垢 |
锅炉内的石膏垢 |
制氧的 垢 |
|
试剂 |
溶液 |
溶液; 溶液 |
饱和 溶液; 柠檬酸溶液 |
浓 溶液 |
| A. |
A |
B. |
B |
C. |
C |
D. |
D |
利用金属 、海水及其中的溶解氧可组成电池,如图所示。下列说法正确的是( )

| A. |
电极为电池正极 |
| B. |
电池工作时,海水中的 向 电极移动 |
| C. |
电池工作时,紧邻 电极区域的海水呈强碱性 |
| D. |
每消耗 ,电池最多向外提供 电子的电量 |
各相关物质的燃烧热数据如表。下列热化学方程式正确的是( )
|
物质 |
|
|
|
|
|
|
|
|
| A. |
|
| B. |
|
| C. |
|
| D. |
|