在一固定容积的容器中进行如下反应:H2(g)+ I2(g)  2HI(g),下列情况一定能说明反应已达到限度的是
2HI(g),下列情况一定能说明反应已达到限度的是
| A.H2、 I2、HI的浓度之比为1 : 1 : 2时 |
| B.气体的总质量不再改变时 |
| C.混合气体中各组分的含量不再改变时 |
| D.单位时间内每消耗1 mol I2,同时有2 mol HI生成时 |
一种使用阴离子交换膜(只也许阴离子通过)的铜锌电池结构结构如下图: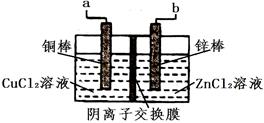
以下选项两栏内容正确且相关联的是
| 选项 |
操作与现象 |
解释与推论 |
| A |
电池放电时化学能转化为电能 |
Zn(s)+ Cu2+(aq)= Zn2+ + Cu(s)△H>0 |
| B |
该电池充电时铜棒变细 |
两电极区溶液颜色都变深 |
| C |
该电池放电时铜棒是电池正极 |
Cl-通过交换膜从左(铜棒区)向右(锌棒区)移动 |
| D |
该电池充电时a接电源正极 |
电极反应Cu2++2e- = Cu |
0.1 mol•L-1 AlCl3溶液,温度从20℃升高到50℃,浓度增幅最大的离子是
| A.Cl- | B.Al3+ | C.H+ | D.OH- |
下列离子方程式正确的是
| A.向Ba(OH)2溶液中滴入硫酸溶液:Ba2++SO42-= BaSO4↓ |
| B.向Na2CO3溶液中通入过量CO2气体:CO32-+CO2+H2O=2HCO3— |
| C.BaCO3溶于醋酸溶液:BaCO3+2H+=Ba2++H2O+CO2↑ |
| D.金属铝溶于氢氧化钠溶液: Al + 2OH-= AlO2- + H2↑ |
常温下,下列各组离子在指定溶液中一定能大量共存的是
| A.0.1 mol•L-1的硫酸溶液:NH4+、Fe2+、Cl-、NO3- |
| B.pH=12的溶液K+、Na+、CH3COO-、Br- |
| C.与铝反应产生大量氢气的溶液: K+、NH4+、HCO3-、Cl- |
| D.酚酞呈红色的溶液:Na+、Fe2+、Cl-、SO42- |
下图是一套实验室制气装置,用于发生、干燥和收集气体。下列各组物质中能利用这套装置进行实验的是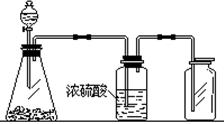
| A.碳酸钙和稀盐酸 | B.二氧化锰和浓盐酸 |
| C.锌粒和稀硫酸 | D.碱石灰和浓氨水 |