气体A的产量是衡量一个国家石油化工发展水平的标志,D是食醋中的主要成分。A能发生以下转化: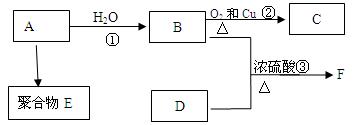
(1)A的结构简式为: 。
(2)E是(写结构简式) ;D中含官能团名称 ;
(3)写出相应转化过程的反应化学方程式
②: 反应类型: 反应
③: 反应类型: 反应
(10分)以下一些氧化物和单质之间可以发生如下图所示的反应:
其中,氧化物(I)是红棕色固体,氧化物(II)、(III)、(IV)在反应条件下都是气体。
(1)氧化物(I)的化学式(分子式)是。
氧化物(II)的化学式(分子式)是。
(2)反应①的化学方程式是。
反应②的化学方程式是
反应③的化学方程式是
(13分)X、Y、Z、W是原子序数依次增大的短周期元素,且互不同族;其中只有两种为金属;X原子的最外层电子数与次外层电子数相等;X与W、Y与Z这两对原子的最外层电子数之和均为9。单质Y和W都可与浓的NaOH溶液反应。请回答下列问题:
(1)Y、Z、W的原子半径由小到大的顺序是________________________。
(2)ZW2的电子式是____________,它在常温下呈液态,形成晶体时,属于______晶体。
(3)工业生产单质Y的原理是_____________________________(用化学方程式表示)。
(4)X与Y化学性质相似,则X与浓的NaOH溶液反应的化学方程式是__________________。
(5)0.1 mol的单质W与50 mL 1.5 mol/L的FeBr2溶液反应,则被氧化的Fe2+ 和Br-的物质的量之比是___________。
化学实验中,如使某步中的有害产物作为另一步的反应物,形成一个循环,就可不再向环境排放该种有害物质。例如:
(l)在上述有编号的步骤中,需用还原剂的是,需用氧化剂的是(填编号)。
(2)在上述循环中,既能与强酸反应又能与强碱反应的两性物质是(填化学式)
(3)完成并配平步骤①的化学方程式,标出电子转移的方向和数目:
□Na2Cr2O7+□KI+□HCl→□CrCl3+□NaCl+□KCl+□I2+□
等物质的量浓度的下列物质的浓度,①NaCl②CH3COONa ③NH4Cl ④AlCl3 ⑤苯酚钠溶液⑥Ba(OH)2⑦Na2CO3⑧NaHCO3 ⑨NaHSO4⑩NaOH 11H2SO4
其pH值由大到小的顺序是。
海水中富含氯元素。
(1)KCl广泛应用于医药和农业,KCl晶体中基态的氯离子电子排布式为
(2)下列是部分金属元素的电离能
| X |
Y |
Z |
|
| 第一电离能(KJ/mol) |
520.2 |
495.8 |
418.8 |
已知X Y Z 的价层电子构型为nS1,则三种金属的氯化物(RCl)的熔点由高到低的顺序为
(3)RCl用作有机机合成催化剂, 并用于颜料, 防腐等工业。R+中所有电子正好充满K、L、M 三个电子层,它与Cl-形成的晶体结构如图所示。R的元素符号是,与同一个Cl-相连的 R+有个。
(4) 卤代烃在有机合成中作用巨大,烃基的结构对卤代烃的活性有很大的影响。CH3—CH2—Cl和碱溶液容易发生取代反应,而CH2=CH2—Cl 和碱溶液不起作用,请从结构上解释其差异
(5) HCl和 HF结构相似,由于氢键的存在使两者性质上存在较大差异,请列举出由于氢键的影响导致的性质差异