下列叙述正确并能用勒沙特列原理解释的是
A.FeCl3+3NH4SCN Fe(SCN)3+3NH4Cl溶液显红色,加少量NH4Cl固体后颜色变浅 Fe(SCN)3+3NH4Cl溶液显红色,加少量NH4Cl固体后颜色变浅 |
| B.红棕色NO2加压后颜色先变深后变浅 |
| C.SO2催化氧化成SO3的反应,往往需要使用催化剂 |
| D.H2、I2、HI平衡混和气加压后颜色变深 |
下列关于有机化合物存在的叙述中,错误的是
| A.工业酒精中含有乙醇和甲醇 | B.许多水果中含有酯类化合物 |
| C.天然油脂中含有高级脂肪酸甘油酯 | D.煤中含有苯 |
把乙烯和丙烯两种有机物按一定的比例混合,在一定条件下反应,所形成的高分子化合物结构简式可能为
①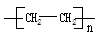 ②
②
③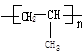 ④.
④.
| A.①③ | B.①②③④ | C.①②③ | D.②④ |
下列不能作为苯分子中碳原子间的化学键是一种介于C-C和C=C之间的特殊的化学键的依据的是
| A.苯不能使溴水褪色 | B.苯不能被酸性高锰酸钾溶液褪色 |
| C.邻二甲苯没有同分异构体 | D.苯分子中6个C原子共平面 |
某煤气的主要成分是CO、H2,把一套以煤气为燃料的灶具改为以天然气为燃料的灶具时,灶具应作相应的调整,正确的方法是
| A.空气和天然气的进入量都减少 |
| B.增大空气的进入量或减小天然气的进入量 |
| C.空气和天然气的进入量都增大 |
| D.减小空气的进入量或增大天然气的进入量 |
下列关于乙烯的叙述错误的是
| A.乙烯分子中6个原子处于同一平面 |
| B.乙烯是一种不饱和烃,结构简式为C2H4 |
| C.乙烯是一种基本化工原料 |
| D.乙烯可使酸性高锰酸钾或溴的四氯化碳溶液褪色 |