已知NaHSO3溶液呈酸性、NaHCO3溶液呈碱性。现有两瓶浓度均为0.1 mol·L-1的NaHSO3溶液和NaHCO3溶液,溶液中各粒子的物质的量浓度存在下列关系(R表示S或C),其中两个溶液中都存在且正确的是
A.c(Na+)>c(HRO3-)>c(H+)>c(RO32-)>c(OH-)
B.c(Na+)+c(H+)=c(HRO3-)+c (RO32-)+c(OH-)
(RO32-)+c(OH-)
C.c(H+)+c(H2RO3)=c(RO32-)+c(OH-)
D.两溶液中c(Na+)、c(HRO3-)、c(RO32-)分别相等
15 g A物质和10.5 g B物质完全反应生成7.2 g C物质和1.8 g D物质和0.3 mol E物质,E物质的摩尔质量为( )
| A.100 g·mol-1 | B.111 g·mol-1 |
| C.55 g·mol-1 | D.27.5 g·mol-1 |
如果3.2 g XO2中含有0.1 mol的氧原子,则X的相对原子质量为( )
| A.32 | B.16 | C.48 | D.8 |
下列说法不正确的是()
| A.64 g氧气中含氧分子数为2NA | B.1.7 g OH-中所含的电子数为NA |
| C.49 g硫酸中所含氧原子数为2NA | D.58.5 g氯化钠中所含的离子数为NA |
下列叙述正确的是( )
| A.1 mol OH-的质量为17 g |
| B.CO2的摩尔质量为44 g |
| C.Fe原子的摩尔质量等于它的相对原子质量 |
D.1个Na原子的质量等于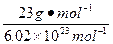 |
下列有关阿伏加德罗常数(NA)的描述正确的是( )
| A.1 mol物质均约含有6.02×1023个分子 |
| B.NA个氢气分子就是1 mol H2 |
| C.1 g氢气约含有6.02×1023个分子 |
| D.NA个12C的质量为12 g |