如图是电解CuCl2溶液的装置,其中c、d为石墨电极。则下列有关的判断正确的是: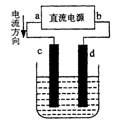
| A.a为负极,b为正极 | B.c为阳极,d为阴极 |
| C.电解过程中,氯离子浓度不变 | D.电解过程中,c电极质量增加 |
甲醛(CH2O)、乙酸(C2H4O2)和丙醛(C3H6O)组成的混合物中,氧元素的质量分数是37%,则氢元素的质量分数为
| A.11% | B.28% | C.54% | D.9% |
下列烷烃在光照下与氯气反应,只生成一种一氯代烃的是
常温常压下,20mL某气态烃与85mL O2混合点燃并完全燃烧后恢复到原来状况,剩余气体为55mL,则此烃的化学式为
| A.C2H4 | B.C2H2 | C.C3H6 | D.C6H6 |
下列说法不正确的是
| A.乙烯、苯都可与溴水发生加成反应 |
| B.乙醇、乙烯都可被酸性高锰酸钾溶液氧化 |
| C.乙醇、乙酸都可以发生酯化反应 |
| D.淀粉、油脂、蛋白质都可以发生水解反应 |
以下几种物质:①白磷、②单晶硅、③甲烷、④四氯化碳,具有正四面体构型的分子的是( )
| A.①②③ | B.①③④ | C.②③④ | D.①②③④ |