实验室配制500mL 0.1mol/L Na2CO3溶液,回答下列问题:
(1)应用托盘天平称取石碱晶体(十水碳酸钠)________g;
(2)配制Na2CO3溶液时需要使用的主要仪器有托盘天平、烧杯、钥匙、________、________、________、
(3)若实验遇到下列情况,溶液的浓度是偏高,偏低还是不变?
①加水时超过刻度线,再用滴管吸出直至刻度线________;
②忘记将洗涤液加入容量瓶________;
③容量瓶内壁附有水珠而未干燥处理________;
④定容后摇匀,液面低于刻度线________。
毒重石的主要成分BaCO3(含Ca2+、Mg2+、Fe3+等杂质),实验室利用毒重石制备BaCl2.2H2O的流程如下:
(1)写出“浸取”环节发生的主要反应的离子方程式:____ 。实验室用37%的盐配置15%的盐酸,除量筒外还需使用下列仪器中的__________。
a.烧杯 b.容量瓶 c.滴定管 d.玻璃棒
(2)下图是一些难溶氢氧化物在不同pH下的沉淀一溶解图
①滤渣I中含 (填化学式)。再加入NaOH调节pH =12.5可除去_____________(填离子符号)。
②加入H2C204应避免过量的原因是_____________。
(3)25℃,H2C204和HF两种酸的电离平衡常数如下: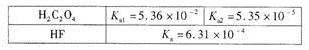
①HC2O4-的电离平衡常数表达式Ka2=________。
②H2C2O4溶液和NaF溶液反应的离子方程式为__________
FeSO4.7H2O俗称“绿矾”,是一种蓝绿色晶体。某课外活动小组同学在实验室发现一瓶绿矾已部分变质,拟用该试剂为原料,重新制取FeSO4.7H2O晶体,并测定其纯度。
【查阅资料】
①绿矾化学性质常不稳定,在潮湿空气中逐渐氧化变质,久置的绿矾溶液逐渐变为黄色,并出现棕黄色浑浊;
②硫酸亚铁的溶解度随温度升高而增大。
【制备晶体】
①取一定量已变质的“绿矾”于烧杯中,加适量水,搅拌,得到棕黄色悬浊液。
②加入一定量稀H2SO4和过量铁屑,在60℃左右水浴中加热,充分反应,待溶液完全变为浅绿色为止。
③趁热过滤,并用少量热水洗涤,将滤液转入到密闭容器中,静置、冷却结晶。
④待结晶完毕后,过滤出晶体,用少量冰水洗涤,再用滤纸吸干水分,最后放人广口瓶中密闭保存。
请回答下列问题:
(1)完成久置绿矾溶液在空气中变质反应的离子方程式:
(2)实验步骤②中加入稀硫酸的目的是_____________
(3)实验步骤③中趁热过滤目的是_____________
(4)实验中两次用到过滤操作,完成该操作的玻璃仪器有烧杯、 。
【测定纯度】
有同学认为,制备过程中可能有少量Fe2+被氧化为Fe3+,导致产品不纯。他们设计了如下方案测定产品的纯度。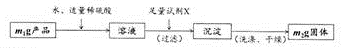
请回答下列问题:
限选试剂:NaOH溶液、KSCN溶液、H2O2溶液、苯酚稀溶液、K3[Fe(CN)6]溶液、BaCl2溶液
(5)检验产品中是否含有Fe3+的无机试剂最好是:_____________。
(6)试剂X是:_____________。
(7)产品中FeSO4.7H2O(摩尔质量为278 g/mol)的含量为:_____________(用质量分数表示)。
在呼吸面具和潜水艇中可用过氧化钠作为供氧剂。在实验室里按下图所示装置,可进行模拟实验证明Na2O2的供氧作用。
(1)A中发生反应的离子方程式是 。
(2)填写表中空格。
| 仪器 |
加入试剂 |
加入该试剂的目的 |
| B |
饱和NaHCO3溶液 |
|
| D |
(3)试管F中收集满气体后,验证该气体的实验操作方法是 。
(4)C中反应的化学方程式是 。
某研究性学习小组欲由硫铁矿烧渣(主要成分为Fe、Fe2O3、SiO2、Al2O3 )制备绿矾(FeSO4·7H2O),流程图如下:
(1)操作a的名称是 。
(2)加入足量试剂X后,发生反应的离子方程式为 、 。
(3)若向溶液2中滴加KSCN溶液,无明显现象。固体与足量稀硫酸发生反应的离子方程式是 、 、 。
某化学实验小组的同学为探究和比较SO2和氯水的漂白性,设计了如下的实验装置。
(1)小组同学在实验时,当打开A的分液漏斗的下面活塞后,发现漏斗内的液体未流下,其原因可能是 。
(2)配平装置E中反应的化学化学方程式:
MnO2 + HCl(浓) MnCl2 + +
MnCl2 + +
(3)A、E均开始反应,当观察到B、D中的品红溶液均已褪色时,停止反应通气。取下B、D两个试管,分别加热,出现的现象是 。
(4)当小组同学将SO2和Cl2按体积比1:1,同时通入到品红溶液时,观察到品红溶液几乎没有出现褪色现象,分析其原因可能是(用化学用语表示) 。