某课外小组设计的实验室制取乙酸乙酯的装置如图所示,A中放有浓硫酸,B中放有乙醇、无水醋酸钠,D中放有饱和碳酸钠溶液。已知
①无水氯化钙可与乙醇形成难溶于水的CaCl2·6C2H5OH
②有关有机物的沸点:
| 试剂 |
乙醚 |
乙醇 |
乙酸 |
乙酸乙酯 |
| 沸点(℃) |
34.7 |
78.5 |
118 |
77.1 |
请回答:
(1)浓硫酸的作用是___________、___________;若用同位素18O示踪法确定反应产物水分子中氧原子的提供者,写出能表示18O位置的化学方程式 。
(2)球形干燥管C的作用是___________、____________。若反应前向D中加入几滴酚酞,溶液呈红色,产生此现象的原因是(用离子方程式表示)___________________;反应结束后D中的现象是_____________、_______________。
(3)从D中分离出的乙酸乙酯中常含有一定量的乙醇、乙醚和水,应先加入无水氯化钙,__________(填操作名称)后,除去_______________;然后对液体混合物进行蒸馏,收集________℃左右的馏分,以得到较纯净的乙酸乙酯。
为比较Fe3+和Cu2+对H2O2分解的催化效果甲乙两组同学分别设计了如图一、图二所示的实验。
(1)图一可通过观察_____________________________ 现象来定性比较得出结论。有同学提出将CuSO4改为CuCl2更为合理,其理由是__________________________,
你认为还可以作其他何种改进? _____________________________________________。
(2)图二可用于定量比较反应的快慢,检查图二装置气密性的方法是。
利用图二做实验时需测量的数据是。
下列装置是用燃烧法确定有机物分子式常用的装置。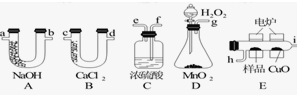
(1)产生的O2按从左到右的流向,所选装置各导管的正确连接顺序是_________。
(2)C装置中浓硫酸的作用是________________________。
(3)D装置中MnO2的作用是_______________________。
(4)燃烧管中CuO的作用是_____________________。
(5)若实验中所取样品只含C、H、O三种元素中的两种或三种,准确称取0.92 g样品,经充分反应后,A管质量增加1.76 g,B管质量增加1.08 g,则该样品的实验式为_________。
(6)要确定该物质的分子式,还要知道该物质的________。经测定其蒸气密度为2.054 g/L(已换算为标准状况下),则其分子式为____________。
(7)该物质的核磁共振氢谱如图所示,则其结构简式为____________________。 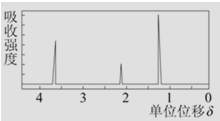
(9分)8.34gFeSO4·7H2O样品受热脱水过程的热重曲线(样品质量随温度变化的曲线)如下图所示。
请回答下列问题:
(1)试确定78℃时固体物质M的化学式:。
(2)取适量380℃时所得的样品P,隔绝空气加热至650℃,得到一种固体物质Q,同时有两种无色气体生成,写出该反应的化学方程式。
(3)某兴趣小组用如图所示装置设计实验,验证(2)中生成的气态物质,并测定已分解的P的质量(不考虑装置内空气的影响)。
①试剂X的名称是。
②按气流方向连接各仪器,用字母表示接口的连接顺序:c→ 。
③充分反应后,利用装置III中圆底烧瓶内混合物测定已分解的P的质量,其操作步骤为:第一步:向圆底烧瓶中逐滴加入氯化钡溶液,直至沉淀完全;第二步:过滤混合物,在过滤器上将沉淀洗净后,烘干并冷却至室温,称重。第三步:继续烘干、冷却并称量直至连续两次称量的质量差不超过0.1g为止。若最终得到沉淀的质量为Wg,则已分解的P的质量(填计算式)。
石蜡油(17个碳原子以上的液态烷烃混合物)的分解实验装置如图所示(部分仪器已省略)。在试管①中加入石蜡油和氧化铝(催化石蜡分解);试管②放在冷水中,试管③中加入溴水。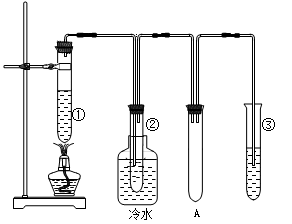
实验现象:
试管①中加热一段时间后,可以看到试管内液体沸腾;
试管②中有少量液体凝结,闻到汽油的气味,往液体中滴加几滴高锰酸钾酸性溶液颜色褪去。根据实验现象回答下列问题:
(1) 装置A的作用是______________________________
(2) 试管①中发生的主要反应有:
C17H36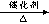 C8H18+C9H18 C8H18
C8H18+C9H18 C8H18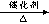 C4H10+C4H8
C4H10+C4H8
丁烷可进一步裂解,除得到甲烷和乙烷外,还可以得到另两种有机物,它们的结构简式为_____________和________________,这两种有机物混合后在一定条件下可聚合成高分子化合物,其反应类型属于________反应。其可能结构为( )(答案可能不止一个,下同)
(3)写出试管③中反应的一个化学方程式_____________________________,该反应的类型为__________反应。
(4)试管②中的少量液体的组成是____________(填序号)
①甲烷②乙烯③液态烷烃④液态烯烃
某化学兴趣小组为了测定某铁碳合金中铁的质量分数,并探究浓硫酸的某些性质,设计了下图所示的实验装置和实验方案(夹持仪器已省略),请据此项回答相应问题。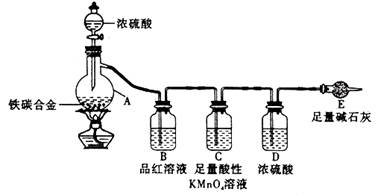
Ⅰ探究浓硫酸的某些性质
(1)按图示连接装置,检查装置的气密性,称量E的质量。
(2)将a g铁碳合金样品放入A中,再加入适量的浓硫酸。仪器A的名称为____________,
未点燃酒精灯前,A、B均无明显现象,其原因是:_______。
(3)点燃酒精灯一段时间后,A、B中可观察到明显现象。
A中开始发生反应的化学方程式为:2Fe +6H2SO4 Fe2(SO4)3 + 3SO2↑ +6H2O
Fe2(SO4)3 + 3SO2↑ +6H2O
和______________________________________ (写化学方程式)。
B中的现象是_________,由此可得到浓硫酸具有_______性,C装置的作用。
(4)随着反应的进行,A中还可能发生某些离子反应。写出相应的离子方程式__ __。
(5)反应一段时间后,从A中逸出气体的速率仍然较快,除因温度较高,反应放热外,还可能的原因是_____________________________________。
Ⅱ测定铁的质量分数
(6)待A中不再逸出气体时,停止加热,拆下E并称重。E增重b g。
铁碳合金中铁的质量分数为_____________________(写表达式),为使实验数据更为精确,可在装有碱石灰的干燥管后加入________________________________。