在绿色化学工艺中,理想状态是反应物中的原子全部转化为欲制得的产物.如用CH3C≡CH合成CH2=C(CH3)COOCH3,欲使原子利用率达到最高,还需要的反应物是
| A.H2和CO2 | B.CO2和H2O | C.CO和CH3OH | D.CH3OH和H2 |
已知反应:2SO2(g)+O2(g)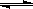 2SO3(g) ΔH<0.某温度下,将2 mol SO2和1 mol O2置于 10 L密闭容器中,反应达平衡后,SO2的平衡转化率(α)与体系总压强(p)的关系如图甲所示。则下列说法正确的是
2SO3(g) ΔH<0.某温度下,将2 mol SO2和1 mol O2置于 10 L密闭容器中,反应达平衡后,SO2的平衡转化率(α)与体系总压强(p)的关系如图甲所示。则下列说法正确的是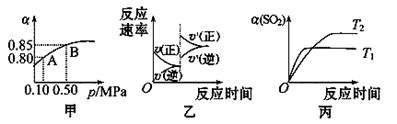
| A.由图甲知,B点SO2的平衡浓度为0.3mol·L-1 |
| B.由图甲知,A点对应温度下的平衡常数为80 |
| C.压强为0.50 MPa时不同温度下SO2转化率与温度关系如丙图,则T2>T1 |
| D.达平衡后,缩小容器容积,则反应速率变化图像可以用图乙表示 |
为了测定酸碱反应的中和热,计算时至少需要的数据是
①酸的浓度和体积;②碱的浓度和体积;③比热容;④反应后溶液的质量;
⑤生成水的物质的量;⑥反应前后的温度变化;⑦操作所需时间;
| A.③④⑤⑥ | B.①③④⑤ | C.①②③⑥⑦ | D.①②③④⑤⑥ |
下列溶液一定呈酸性的是
| A.滴加酚酞显无色溶液 | B.含有较多H+的溶液 |
| C.pH<7的溶液 | D.c(OH-)<c(H+)的溶液 |
某化合物6.2 g在O2中完全燃烧,只生成8.8 g CO2和5.4 g H2O。下列说法正确的是
| A.该化合物仅含碳、氢两种元素 |
| B.该化合物中碳、氢原子个数比为1 : 2 |
| C.无法确定该化合物是否含有氧元素 |
| D.该化合物中一定含有氧元素 |
某有机物在氧气中充分燃烧,生成等物质的量的水和二氧化碳,则该有机物必须满足的条件是
A.分子中的C、H、O的个数比为1 : 2 : 3
B.分子中C、H个数比为1 : 2
C.该有机物的相对分子质量为14
D.该分子中肯定不含氧元素