将4molA气体和2molB气体在2L的容器中混 合,并在一定条件下发生如下反应:2A(g)+B(g)
合,并在一定条件下发生如下反应:2A(g)+B(g) 2C(g)。若经过2s测得C的浓度为0.6mol/L,现有下列几种说法,其中正确的是
2C(g)。若经过2s测得C的浓度为0.6mol/L,现有下列几种说法,其中正确的是
①用物质A表示的平均反应速率为0.3mol/L·S ②用物质B表示的平均反应速率为0.6mol/L·S ③2s时物质A的转化率为70% ④2s时物质B的浓度为0.7mol/L
A.①③ B.①④ C.②③ D .③④
.③④
下列解释事实的化学方程式或离子方程式正确的是
| A.用食醋除去暖水瓶中的水垢:2CH3COOH+CaCO3═Ca2++2CH3COO-+CO2↑+H2O |
B.碳酸氢铵溶液中加入足量氢氧化钡溶液:NH4++HCO3—+2OH—═CO32-+NH3 H2O+H2O H2O+H2O |
| C.Fe(NO3)3溶液中加入过量的HI溶液:2Fe3++2I-═2Fe2++I2 |
| D.Ca(HCO3)2溶液中加入少量的NaOH溶液:Ca2++2HCO3-+2OH-═CaCO3↓+ CO32-+2H2O |
下列现象或事实不能用同一原理解释的是
| A.浓硝酸和氯水用棕色试剂瓶保存 |
| B.Na2S和Na2SO3固体长期暴露在空气中会变质 |
| C.Cl2和SO2都能使品红溶液褪色 |
| D.SO2和Na2SO3溶液都能使溴水褪色 |
下列实验现象预测正确的是
| A.实验I:振荡后静置,上层溶液颜色保持不变 |
| B.实验Ⅱ:酸性KMnO4溶液中无明显现象 |
| C.实验III:微热稀HNO3片刻,溶液中有气泡产生,广口瓶内始终保持无色 |
| D.实验Ⅳ:继续煮沸溶液至红褐色,停止加热,当光束通过体系时可产生丁达尔效应 |
下列有关说法,不正确的是
①将盛有二氧化氮气体的试管倒立在水中,溶液会充满试管
②向煤中加入适量石灰石,在煤燃烧时最终生成CaSO4,可减少SO2对大气的污染
③为测定熔融氢氧化钠的导电性,可将氢氧化钠固体放在石英坩埚中加热熔化
④电解从海水中得到的氯化镁溶液可获得金属镁
⑤为证明NaHCO3溶液中混有Na2CO3,取少量溶液,加入澄清石灰水,若有白色沉淀生成,则证明混有Na2CO3
| A.仅①③④⑤ | B.仅②③④ | C.仅①③④ | D.仅①②④⑤ |
将溶液(或气体)X逐渐加入(或通入)到一定量Y溶液中,产生沉淀的质量与加入X的物质的量关系如图,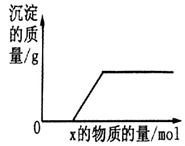
符合图中情况的一组物质是