下列性质的递变规律不正确的是
| A.NaOH、KOH、CsOH碱性依次增强 |
| B.Li、Na、K、Rb、Cs的失电子能力逐渐增强 |
| C.Al3+、Mg2+、Na+的离子半径依次减小 |
| D.F2、Cl2、Br2、I2的熔沸点依次升高、密度依次增大 |
25℃时,几种弱酸的电离常数如下:
| 弱酸的化学式 |
CH3COOH |
HCN |
H2S |
| 电离常数(25℃) |
1.8×10-5 |
4.9×10-10 |
K1=1.3×10-7 K2=7.1×10-15 |
25℃时,下列说法正确的是
A.等物质的量浓度的各溶液pH关系为:pH(CH3COONa)> pH(Na2S) > pH(NaCN)
B.a mol/LHCN溶液与b mol/LNaOH溶液等体积混合,所得溶液中c(Na+)>c(CN-),
则a一定小于或等于b
C.NaHS和Na2S的混合溶液中,一定存在c(Na+)+c(H+)=c(OH-)+c(HS-)+2c(S2-)
D.某浓度的NaCN溶液的pH=d,则其中由水电离出的c(OH-)=10-dmol/L
下列根据实验操作和现象所得出的结论正确的是
| 选项 |
实验操作 |
实验现象 |
结论 |
| A |
淀粉溶液中加稀硫酸,加热片刻,滴加银氨溶液,再水浴加热 |
无银镜生成 |
淀粉未发生水解 |
| B |
向溶液X中加入稀盐酸,并将产生的无色气体通入澄清石灰水中 |
生成白色沉淀 |
溶液X中一定含有CO32-或HCO3- |
| C |
将一片铝箔置于酒精灯外焰上灼烧 |
铝箔熔化但不滴落 |
铝箔表面有致密Al2O3薄膜,且Al2O3熔点高于Al |
| D |
取久置的绿矾(FeSO4·7H2O)溶于水,加入KSCN溶液 |
溶液变为血红色 |
绿矾部分或全部被氧化 |
霉酚酸酯(MMF)是器官移植中抑制细胞增殖最常用的药物,它在酸性溶液中能发生如下反应: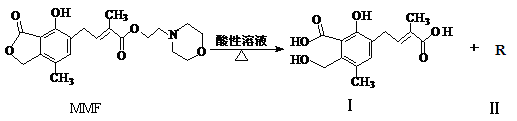
下列说法中正确的是
| A.1molMMF与足量NaOH 溶液共热,最多可消耗3molNaOH |
| B.可以用NaHCO3溶液区别MMF与化合物Ⅰ |
| C.化合物R 的分子式为C6H12NO2 |
| D.MMF分子中含有三种官能团 |
下列说法正确的是
| A.镀锌铁板是利用了牺牲阳极的阴极保护法来达到防止腐蚀的目的 |
| B.在滴有酚酞的Na2CO3溶液中,加入BaCl2溶液后红色褪去,说明BaCl2溶液显酸性 |
| C.合成氨反应需使用催化剂,说明催化剂可以促进该平衡向生成氨的方向移动 |
D.汽车尾气的净化反应2NO+2CO 2CO2+N2△H<0,则该反应一定能自发进行 2CO2+N2△H<0,则该反应一定能自发进行 |
Q、W、X、Y、Z是原子序数依次增大的短周期元素,X的焰色反应呈黄色。Q元素的原子最外层电子数是其内层电子数的2倍。W、Z最外层电子数相同,Z的核电荷数是W的2倍。元素Y的合金是日常生活中使用最广泛的金属材料之一,下列说法正确的是
| A.原子半径的大小顺序:rX>rY> rW >rQ |
| B.X、Y的最高价氧化物的水化物之间不能发生反应 |
| C.元素Q和Z能形成QZ2型的共价化合物 |
| D.Z元素的氢化物稳定性大于W元素的氢化物稳定性 |