下列物质中,含有非极性共价键的离子化合物的是
| A.NH4NO3 | B.Cl2 | C.H2O2 | D.Na2O2 |
下列叙述与对应图式正确的是
A.由下列短周期元素性质的数据推断③元素最高价氧化物对应的水化物碱性最强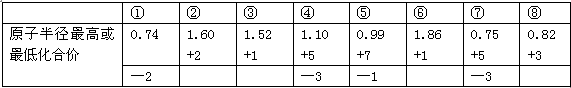 |
B.图甲表示Zn—Cu原电池反应过程中的电流强度的变化。T时可能加入了H2O2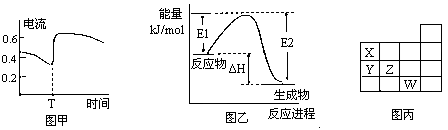 |
| C.图乙表示某一放热反应,若使用催化剂E1、E2、△H都会发生改变 |
| D.图丙表示元素周期表的一部分,元素X,Y,Z、W中X的氢化物酸性最强 |
再生氢氧燃料电池(RFC)是一种将水电解技术与氢氧燃料电池技术相结合的可充电电池。图为RFC工作原理示意图,下列有关说法正确的是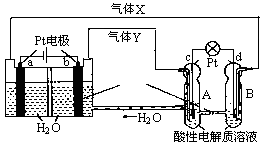
图1图2
A.图1把化学能转化为电能,图2把电能转化为化学能,水得到了循环使用
B.a极上发生氧化反应,产生的气体X是H2
C.图2溶液中阳离子从B极流向A极
D.c极上发生的电极反应是O2+2H2O+4e-=4OH-
硫酸奎宁片是一种防治热病尤其是疟疾的特效药,其结构简式如图所示。下列关于硫酸奎宁的描述正确的是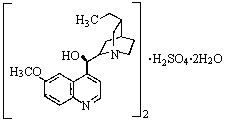
| A.硫酸奎宁的相对分子质量是458 |
| B.不能使酸性KMnO4溶液褪色 |
| C.能发生加成、取代、消去反应 |
| D.1mol该物质最多可与lmolNaOH反应 |
实验是化学研究的基础,下列关于各实验装置的叙述正确的是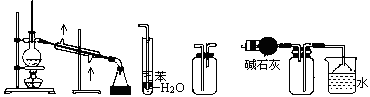
①②③④
| A.装置①常用于分离互相溶解且沸点相差10℃以上的液态混合物 |
| B.装置②可用于吸收NH3或HCl气体,并防止到吸 |
| C.装置③可用于收集H2、CO2、Cl2、NH3等气体 |
| D.装置④可用于干燥、收集氨气,若将碱石灰改成五氧化二磷,可用于干燥、收集氯化氢 |
下列各组物质,不能按照关系X—Y—Z—X(“—”表示反应一步完成)相互转化的是
| 物质 |
A |
B |
C |
D |
| X |
CaO |
BaCl2 |
Cu(NO3)2 |
K2SO4 |
| Y |
CaCl2 |
Ba(NO3)2 |
Cu(OH)2 |
KCl |
| Z |
CaCO3 |
BaCO3 |
CuSO4 |
KNO3 |