高温下,某反应达到平衡,平衡常数K=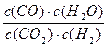 。恒容时,温度升高,H2浓度减小。下列说法正确的是
。恒容时,温度升高,H2浓度减小。下列说法正确的是
| A.该反应是焓变为正值 | B.恒温恒容下,增大压强,H2浓度一定减小 |
| C.升高温度,逆反应速率减小 | D.该反应化学方程式为CO+H2O CO2+H2 CO2+H2 |
设C+CO2 2CO(正反应为吸热反应),反应速率为v1;N2+3H2
2CO(正反应为吸热反应),反应速率为v1;N2+3H2 NH3(正反应为放热反应),反应速率为v2,当温度升高时,v1和v2的变化情况为( )
NH3(正反应为放热反应),反应速率为v2,当温度升高时,v1和v2的变化情况为( )
| A.同时增大 |
| B.同时减小 |
| C.发v1增大,v2减小 |
| D.v1减小,v2增大 |
100mL6mol/L H2SO4跟过量锌粉反应,一定温度如下,为了减缓反应进行的速率,但又不影响生成氢气的总量,可向反应物中加入适量的( )
| A.碳酸钠固体 |
| B.醋酸钠固体 |
| C.硫酸钾溶液 |
| D.硫酸铵固体 |
X、Y、Z为三种气体。把amolX和bmolY充入一密闭容器中。发生反应X+2y=2Z,达到平衡时,若它们的物质的量满足:n(X)+n(Y)=n(Z),则Y的转化率为( )
| A.[(a+b)/5]×100% |
| B.[2(a+b)/5b]×100% |
| C.[2(a+b)/5]×100% |
| D.[(a+b)/5a]×100% |
反应2X(气)+Y(气)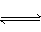 2Z(气)(正反应为放热反应),在不同温度(T1和T2)及压强(P1和P2)下,产物Z的物质的量[n(z)]与反应时间(t)的关系如图所示。下列判断正确的是( )
2Z(气)(正反应为放热反应),在不同温度(T1和T2)及压强(P1和P2)下,产物Z的物质的量[n(z)]与反应时间(t)的关系如图所示。下列判断正确的是( ) 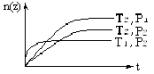
| A.T1<T2,P1<P2 |
| B.T1<T2,P1>P2 |
| C.T1>T2,P1>P2 |
| D.T1>T2,P1<P2 |
在一密闭容器中,反应aA(气)=bB(气)达平衡后,保持温度不变,将容器体积增加一倍,当达到新的平衡时,B的浓度是原来的60%则( )
| A.平衡向正反应方向移动了 |
| B.物质A的转化率减少了 |
| C.物质B的质量分数增加了 |
| D.a>b |