某课外兴趣小组欲测定某NaOH溶液的浓度,其操作步骤如下: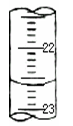
①用0.1000mol/L的标准盐酸润洗酸式滴定管2~3次
②取标准盐酸注入酸式滴定管至“0”刻度以上2~3mL处
③把盛有标准盐酸的酸式滴定管固定好,调节滴定管尖嘴使之充满溶液
④调节液面至“0”或“0”刻度以下,记下读数
⑤取20.00mL待测NaOH溶液注入洁净的锥形瓶中,并加入2~3滴甲基橙试液
⑥把锥形瓶放在滴定管的下面,用标准盐酸滴定至终点,记录滴定管读数
请回答下列问题:
(1)判断到达滴定终点的现象是 。
(2)某次滴定时的滴定管中的液面如右图所示,其读数为 mL。
(3)根据下列数据:
| 滴定次数 |
待测液体积(mL) |
标准盐酸体积(mL) |
|
| 滴定前读数(mL) |
滴定后读数(mL) |
||
| 第一次 |
20.00 |
0.50 |
25.40 |
| 第二次 |
20.00 |
4.00 |
29.10 |
请计算待测烧碱溶液的浓度为 mol/L。
(4)下列实验操作会使实验结果偏高的是 。
A、锥形瓶用待测液润洗后再注入待测液
B、酸式滴定管未用标准液润洗,便装入标准液
C、酸式滴定管滴定前俯视读数,滴定后仰视读数
D、酸式滴定管滴定前有气泡,滴定后无气泡
已知下列热化学方程式:
①CH3COOH(l)+2O2(g)===2CO2(g)+2H2O(l) ΔH1=-870.3 kJ/mol;
②C(s)+O2(g)===CO2(g) ΔH2=-393.5 kJ/mol;
③H2(g)+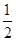 O2(g)===H2O(l)ΔH3=-285.8 kJ/mol。
O2(g)===H2O(l)ΔH3=-285.8 kJ/mol。
则反应2C(s)+2H2(g)+O2(g)===CH3COOH(l)的ΔH为( )
| A.-488.3 kJ/mol |
| B.-244.15 kJ/mol |
| C.+488.3 kJ/mol |
| D.+244.15 kJ/mol |
对可逆反应2A(s)+3B(g)  C(g)+2D(g)ΔH<0,在一定条件下达到平衡,下列有关叙述正确的是()
C(g)+2D(g)ΔH<0,在一定条件下达到平衡,下列有关叙述正确的是()
①增加A的量,平衡向正反应方向移动
②升高温度,平衡向逆反应方向移动,v(正)减小
③压强增大一倍,平衡不移动,v(正)、v(逆)不变
④增大B的浓度,v(正)>v(逆)
⑤加入催化剂,B的转化率提高
| A.①② | B.④ | C.③ | D.④⑤ |
在一定温度时,N2与H2反应过程中能量变化的曲线如右图所示。下列叙述正确的是( )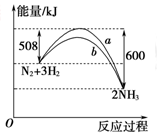
| A.该反应的热化学方程式:N2+3H2 = 2NH3 ΔH=-92 kJ/mol |
| B.b曲线是加入催化剂时的能量变化曲线 |
| C.加入催化剂,该化学反应放出的热量增多 |
| D.加入催化剂可增大正反应速率,降低逆反应速率 |
S2Cl2是广泛用于橡胶工业的硫化剂,常温下S2Cl2是一种橙黄色的液体,遇水易水解,并产生能使品红褪色的气体,其结构与H2O2类似。下列说法错误的是( )
| A.S2Cl2分子中的两个S原子均是sp3杂化 |
| B.S2Cl2与H2O反应的化学方程式可能为:2S2Cl2+2H2O=SO2↑+3S↓+4HCl |
| C.S2Br2与S2Cl2结构相似,熔沸点S2Br2>S2Cl2 |
| D.S2Cl2分子中的S为+1价,是含有极性键和非极性键的非极性分子 |
一定温度下,在固定体积的密闭容器中发生反应:2HI(g) = H2(g)+I2(g).若c(HI)由0.1 mol·L-1降到0.07 mol·L-1需要15 s,那么c(HI)由0.07 mol·L-1时降到0.05 mol·L-1时,所需反应的时间为( )
| A.等于5 s | B.等于10 s | C.大于10 s | D.小于10 s |