二氧化锰是制造锌锰干电池的基本原料,普通锌锰干电池的电池反应式为:
2MnO2+Zn+2H2O=2MnOOH+Zn(OH)2。工业上以软锰矿为原料,利用硫酸亚铁制备高纯度二氧化锰的流程如下(软锰矿中所有金属元素在酸性条件下均以阳离子形式存在):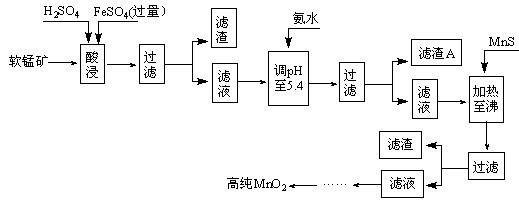
某软锰矿的主要成分为MnO2,还含Si(16.27%)、Fe(5.86%)、Al(3.24%)、Zn(2.68%)和Cu(0.86%)等元素的化合物。部分阳离子以氢氧化物形式完全沉淀时,溶液的pH及部分硫化物的Ksp(均为25℃时)见下表,回答下列问题:
| 沉淀物 |
Al(OH)3 |
Fe(OH)3 |
Fe(OH)2 |
Mn(OH)2 |
Cu(OH)2 |
Zn(OH)2 |
| pH |
5.2 |
3.2 |
9.7 |
10.4 |
6.7 |
8.0 |
| 沉淀物 |
CuS |
ZnS |
MnS |
FeS |
|
|
| Ksp |
8.5×10-45 |
1.2×10-23 |
1.4×10-15 |
3.7×10-14 |
|
|
(1)硫酸亚铁在酸性条件下将MnO2还原为MnSO4,酸浸时发生的主要化学方程式为:
。
(2)滤渣A的主要成分为 。
(3)加入MnS的目的是除去 杂质。
(4)碱性锌锰电池中,MnO2参与的电极反应式为 。
(5)从废旧碱性锌锰电池中可回收利用的物质有 (写两种)。
下列实验装置不能达到实验目的的是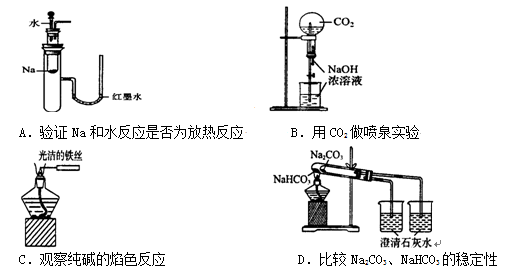
粒子甲在溶液中的转化关系如下图所示,粒子甲不可能是
| A.NH4 + | B.Al(OH)3 | C.S | D.Al |
下列说法不正确的是
①将BaSO4放入水中不能导电,所以BaSO4是非电解质
②氨溶于水得到的氨水能导电,所以氨水是电解质
③固态共价化合物不导电,熔融态的共价化合物可以导电
④固态的离子化合物不导电,熔融态的离子化合物也不导电
⑤强电解质溶液的导电能力一定比弱电解质溶液的导电能力强.
| A.①④ | B.①④⑤ | C.①②③④ | D.①②③④⑤ |
反应: Mn2++BiO3- +H+→MnO4-+Bi3++H2O,配平后, H+的化学计量数为
| A.8 | B.10 | C.14 | D.30 |
已知某强酸性的溶液中存在大量的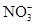 ,下列有关该溶液中还存在的物质叙述正确的是
,下列有关该溶液中还存在的物质叙述正确的是
A.铝元素能以Al3+或 的形式存在 的形式存在 |
| B.铁元素能以Fe2+和Fe3+的形式共存 |
C.硫元素主要以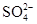 的形式存在 的形式存在 |
| D.氯元素能以Cl-或ClO-的形式存在 |