在一定温度下,容器内某一反应中M、N的物质的量随反应时间变化的曲线如下图,下列表述中正确的是
A.反应的化学方程式为:2M N N |
| B.t2时,正逆反应速率相等,达到平衡 |
| C.t3时,正反应速率大于逆反应速率 |
| D.t1时,N的浓度是M浓度的2倍 |
乙酸蒸气能形成二聚分子:2CH3COOH(g) (CH3COOH)2(g),正反应放热;现欲测定乙酸的相对分子质量,应采用的条件是( )
(CH3COOH)2(g),正反应放热;现欲测定乙酸的相对分子质量,应采用的条件是( )
| A.高温低压 | B.低温高压 |
| C.低温低压 | D.高温高压 |
在一定条件下,可逆反应:2SO2(g)+O2(g) 2SO3(g)(正反应为放热反应)达到平衡,当单独改变下列条件后,有关叙述正确的是( )
2SO3(g)(正反应为放热反应)达到平衡,当单独改变下列条件后,有关叙述正确的是( )
| A.加催化剂,v(正)和v(逆)都发生变化,且变化的倍数相等 |
| B.加压,v(正)、v(逆)都增大,且v(正)增大的倍数大于v(逆)增大的倍数 |
| C.降温,v(正)减小,v(逆)增大,平衡向正方向移动 |
| D.充入氩气,v(正)、v(逆)都增大,且v(正)增大的倍数大于v(逆)增大的倍数 |
在密闭容器中进行下列反应:M(g)+N(g) R(g)+2 L,此反应符合下面图象。下列叙述正确的是( )
R(g)+2 L,此反应符合下面图象。下列叙述正确的是( )
| A.正反应吸热,L是气体 | B.正反应吸热,L是固体 |
| C.正反应放热,L是液体 | D.正反应放热,L是气体 |
在容积相同且固定不变的四个密闭容器中进行如下同样的可逆反应:2A(g)+B(g)  3C(g)+2D(g),起始时,四个容器所盛A、B的量分别是:
3C(g)+2D(g),起始时,四个容器所盛A、B的量分别是:
甲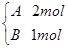 乙
乙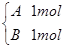 丙
丙 丁
丁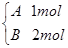
在相同温度下建立平衡时,A或B的转化率大小关系是( )
A.A的转化率:甲<丙<乙<丁 B.A的转化率:甲<乙<丙<丁
C.A的转化率:甲<乙=丙<丁 D.B的转化率:甲>丙>乙>丁
体积相同的甲、乙两个容器中,分别都充有等物质的量的SO2和O2,在相同温度下发生反应:2SO2+O2 2SO3,并达到平衡。在这一过程中,甲容器保持体积不变,乙容器保持压强不变,若甲容器中SO2的转化率为p%,则乙容器中SO2的转化率( )
2SO3,并达到平衡。在这一过程中,甲容器保持体积不变,乙容器保持压强不变,若甲容器中SO2的转化率为p%,则乙容器中SO2的转化率( )
| A.等于p% | B.大于p% | C.小于p% | D.无法判断 |