如图所示,在用锌片、铜片和稀硫酸组成的原电池装置中,下列说法正确的是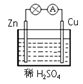
| A.铜电极上的反应为Cu-2e-==Cu2+ |
| B.放电时溶液中的阳离子向锌片移动 |
| C.电池工作一段时间后溶液的pH值减小 |
| D.该电池的负极材料是锌片 |
下列说法正确的是
| A.石油经过分馏及裂化等工序得到的物质均为纯净物 |
| B.乙酸乙酯、油脂、葡萄糖、蛋白质均可以发生水解反应 |
| C.乙醇、乙酸均能与Na反应放出H2,二者分子中官能团相同 |
| D.苯不能使酸性高锰酸钾溶液银色,说明苯分子中没有与乙烯分子中类似的碳碳双键 |
下列说法正确的是
A短周期元素形成离子后,最外层均达8电子稳定结构
B.多电子原子中,在离核较近的区域运动的电子能量较低
C.非金属元素组成的化合物中只有共价键
D. HF、HCl、HBr、HI的热稳定性和还原性依次增强
下列说法正确的是
| A.医疗上可用硫酸钡作X射线透视肠胃的内服药,主要原因是硫酸钡不溶于水 |
| B.金属材料都是导体,非金属材料都是绝缘体 |
| C.PM2.5是指大气中直径小于或等于2.5μm的颗粒物,我国已将其纳入空气质量检测范围 |
| D.钢铁在海水中比在河水中更易腐蚀,主要原因是海水含氧髙于河水 |
下列有关实验的结论正确的是
| 选项 |
实验操作及现象 |
实验结论 |
| A |
向某溶液中加入盐酸酸化的氯化钡溶液,有白色沉淀生成 |
溶液中一定含有 |
| B |
向某溶液中加入盐酸,产生能使澄清石灰水变浑浊的无色气体 |
溶液中一定含有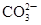 |
| C |
用酸度计测定SO2和CO2饱和溶液的pH,前者pH小 |
H2SO3酸性强于H2CO3 |
| D |
用玻璃棒蘸取浓氨水点到红色石蕊试纸上,试纸变蓝色 |
浓氨水呈碱性 |
下列各组离子在指定条件下,一定能大量共存的是
A.能使蓝色石蕊试纸变红色的溶液: 、 、 、 、 、 、 |
B.c(H+)=0.1mol·L-1的透明溶液: 、 、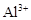 、 、 、 、 |
C.能使氢氧化铝溶解的溶液: 、 、 、 、 、 、 |
D.水电离出的 的溶液: 的溶液: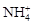 、 、 、 、 、 、 |