下列说法正确的是( )
| A.任何化学反应都伴随着能量的变化 |
| B.1 mol H2SO4和 1 mol Ba(OH)2完全反应所放出的热量称为中和热 |
| C.在101kPa 时,1 mol 碳燃烧放出的热量就是碳的燃烧热 |
| D.在化学反应中需要加热的反应就是吸热反应 |
某温度下,在一个2L的密闭容器中,加入4molA和2molB进行如下反应:3 A(g)+2B(g) 4C(?)+2D(?),反应一段时间后达到平衡,测得生成1.6molC,且反应的前后压强之比为 5:4(相同的温度下测量),则下列说法正确的是
4C(?)+2D(?),反应一段时间后达到平衡,测得生成1.6molC,且反应的前后压强之比为 5:4(相同的温度下测量),则下列说法正确的是
A.该反应的化学平衡常数表达式是K= |
| B.此时,B的平衡转化率是35% |
| C.增大该体系的压强,平衡向右移动,化学平衡常数增大 |
| D.增加C,B的平衡转化率不变 |
已知NH3·H2O(aq)与H2SO4(aq)反应生成1mol正盐的反应热△H= -24.2kJ/moL;稀盐酸与稀氢氧化钠溶液反应的中和热△H= -57.3kJ/mol。则NH3•H2O在水溶液中电离的△H等于
| A.-69.4kJ/mol | B.-45.2 kJ/mol |
| C.+69.4kJ/mol | D.+45.2 kJ/mol |
右图是198K 时N2与H2反应过程中能量变化的曲线图。下列叙述正确的是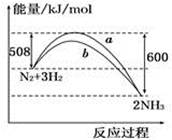
A.该反应的热化学方程式为:N2 + 3H2 2NH3, △H = -92kJ·mol-1 2NH3, △H = -92kJ·mol-1 |
| B.a曲线是加入催化剂时的能量变化曲线 |
| C.加入催化剂, 该化学反应的反应热改变 |
| D.在温度、体积一定的条件下, 通入lmol N2和3molH2反应后放出的热量为Q1kJ, 若通入2molN2和6molH2反应后放出的热量为Q2kJ 则184>Q2 >2Q1 |
下列叙述正确的是
| A.反应物分子间的碰撞一定能发生化学反应 |
B.X(g)+2Y(g)  2Z(g) △H<0,反应达平衡后缩小容器体积,X浓度变小 2Z(g) △H<0,反应达平衡后缩小容器体积,X浓度变小 |
| C.反应NH3(g)+HCl(g)=NH4Cl(s)在室温下可自发进行,则该反应的△H<0 |
D.反应2A(g)+ B(g) 3C(g)△H>0,在一定体积的密闭容器中达平衡后,加入B,反应的△H增大 3C(g)△H>0,在一定体积的密闭容器中达平衡后,加入B,反应的△H增大 |
已知1 g H2完全燃烧生成水蒸气放出热量121 kJ,且O2中1 mol O===O键完全断裂时吸收热量496 kJ,水蒸气中形成1 mol H—O键时放出热量463 kJ,则H2中1 mol H—H键断裂时吸收的热量为( )
| A.920 kJ | B.557 kJ | C.436 kJ | D.188 kJ |