金属镍有广泛的用途。粗镍中含有少量Fe、Zn、Cu、Pt等杂质,可用电解法制备高纯度的镍,下列叙述正确的是(已知:氧化性Fe2+<Ni2+<Cu2+) ( )
| A.阳极发生还原反应,其电极反应式:Ni2+ + 2e— ="=" Ni |
| B.电解过程中,阳极质量的减少与阴极质量的增加相等 |
| C.电解后,溶液中存在的金属阳离子只有Fe2+ 和Zn2+ |
| D.电解后,电解槽底部的阳极泥中只有Cu和Pt |
葡萄糖(C6H12O6)中碳的质量分数是()
| A.40% | B.6.7% | C.53% | D.60% |
人体内重要的储存能量的物质是()
| A.微量元素 | B.油脂 | C.蛋白质 | D.维生素 |
某温度下,在一个2L的密闭容器中,加入4molA和2molB进行如下反应: 3A(g)+2B(g)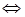 4C(g)+D(g),反应2min后达到平衡,测得生成l.6molC,下列说法正确的是
4C(g)+D(g),反应2min后达到平衡,测得生成l.6molC,下列说法正确的是
| A.前2min,D的平均反应速率为0.2mol·L-1·min-1。 |
| B.此时,B的平衡转化率是40% |
| C.增大该体系的压强,平衡不移动,化学平衡常数不变 |
| D.增加B,平衡向右移动,B的平衡转化率增大 |
下列物质的量浓度关系错误的是
| A.等物质的量浓度的HA溶液与MOH溶液等体积混合:c(H+)+c(M+)=c(OH-)+c(A-) |
| B.pH相等的CH3COONa、NaOH和Na2C03三种溶液:c(NaOH)<c(Na2CO3)<c(CH3COONa) |
| C.物质的量浓度相等的CH3COOH和CH3COONa溶液等体积混合: c(CH3C00-)+2c(OH-)=2c(H+)+c(CH3COOH) |
| D.0.1 mol·L-1的NaHC03溶液:c(Na+)>c<OH-)>c(HC03-)>c(H+) |
将0.4gNaOH和1.06g Na2CO3混合并配成溶液,向溶液中滴加0.1 mol·L-l的盐酸。下列图像能正确表示加入盐酸的体积和生成C02的物质的量的关系的是