乙醇可以发生下列反应,在反应里乙醇分子断裂C—O键而失去羟基的是
| A.乙醇在浓硫酸存在下加热至170℃ | B.乙醇的催化氧化 |
| C.乙醇与钠反应生成氢气 | D.乙醇与浓氢溴酸加热发生取代反应 |
下列离子方程式中,属于水解反应的是( )
A.HCOOH+H2O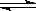 HCOO-+H3O+ HCOO-+H3O+ |
B.CO+H2O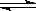 HCO+OH- HCO+OH- |
C.CO2+H2O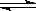 HCO+H+ HCO+H+ |
D.HS-+H2O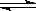 .S2-+H3O+ .S2-+H3O+ |
在氨水中存在下列电离平衡:NH3·H2O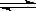 NH+OH-,下列情况能引起电离平衡向正向移动的有( )
NH+OH-,下列情况能引起电离平衡向正向移动的有( )
①加NH4Cl固体 ②加NaOH溶液 ③加HCl
④加CH3COOH溶液 ⑤加水 ⑥加热煮沸
| A.①③⑤ | B.①④⑥ | C.③④⑤ | D.①②④ |
下列有关水的电离的说法正确的是()
| A.将水加热,KW增大,pH不变 |
| B.向水中加入少量NaHSO4固体,恢复到原温度,水的电离程度增大 |
| C.向水中加入少量NH4Cl固体,恢复到原温度,水的电离程度减小 |
| D.向水中加少量NaOH固体,恢复到原温度,水的电离被抑制,[OH-]增大 |
下列说法中,正确的是( )
| A.在化学反应过程中,发生物质变化的同时不一定发生能量变化 |
| B.反应产物的总焓大于反应物的总焓时,反应吸热,ΔH>0 |
| C.破坏生成物全部化学键所需要的能量大于破坏反应物全部化学键所需要的能量时,反应为吸热反应 |
| D.ΔH的大小与热化学方程式的计量数无关 |
有一铁的氧化物样品,用140 mL 5 mol·L-1盐酸可恰好使其完全溶解。所得溶液可吸收标准状况下0.56 L氯气,使其中的Fe2+全部转化为Fe3+。该样品可能的化学式为()
| A.Fe4O5 | B.Fe5O7 | C.Fe2O3 | D.Fe3O4 |