A是一种含碳、氢、氧三种元素的有机化合物,已知:A相对分子质量为144,其中碳的质量分数为50%。A可以使溴水褪色。A难溶于水,但在酸性条件下可发生水解反应,得到B和甲醇。B中碳、氢、氧原子个数比为1:1:1,分子中没有支链,能与氢氧化钠溶液发生反应。
(1)A可以发生的反应有 (选填编号)
① 加成反应 ② 酯化反应 ③ 加聚反应 ④ 氧化反应
(2)B分子所含官能团的名称是 。
(3)与B具有相同官能团的同分异构体的结构简式是 _______________ 。
(4)由B制取A的化学方程式是:
。
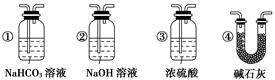
实验室里常见到如图所示仪器,该仪器为两头密封的玻璃管,中间带有一根玻璃短柄。该仪器可进行多项实验,当玻璃管内装有碘晶体时,用此仪器可进行碘升华实验,具有装置简单,操作方便,现象明显,没有污染,可反复使用等优点。
(1)用此仪器不能反复进行的实验是。
A.NH4Cl固体受热分解
B.KMnO4晶体受热分解
C.白磷和红磷在一定温度下互相转变
(2)如果玻璃管内装有某种红色溶液,加热时溶液颜色变浅,冷却时恢复红色,该溶液可能是;如果玻璃管内封有无色溶液,加热溶液时,溶液变红,冷却后恢复原颜色,此溶液可能是。
一定量的浓硫酸与足量Zn充分反应时,有SO2和H2生成。某校化学研究性学习小组分别从定性和定量两方面对此作了研究。
定性实验:按图组装好实验装置,微热试管A,观察实验现象。反应开始后,观察到A试管中Zn与浓硫酸反应,C、D、E中有气泡产生,随后气泡量减少,品红溶液褪色,D中先出现浑浊后浑浊消失。反应较长时间后,C、D、E中的气泡量又会明显增加。试回答下列问题: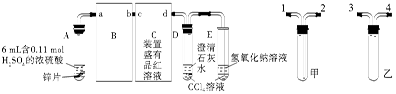
(1)从甲、乙装置选择合适的填入B、C中,并进行正确连接,a接、接b,c接、接d;D、E两支试管中CCl4的作用是。
(2)能证明浓硫酸具有强氧化性的实验现象为;反应较长时间后气泡量又会明显增加的原因是。
(3)一定量的浓硫酸与足量Zn充分反应时,有H2生成的理由是;实验过程中,浓硫酸表现强氧化性的反应方程式是。D中浑浊消失的离子反应方程式是。
定量实验:某化学实验研究性学习小组设计了以下实验,以定量测定反应中生成的SO2和H2的体积之比。
取A试管中充分反应后的溶液2 mL(假设反应前后溶液的体积不变),配制成100 mL溶液。然后取稀释液20.00 mL滴加BaCl2溶液使沉淀完全,过滤、洗涤、干燥沉淀,称量所得沉淀为1.4 g。
(4)完成定量实验部分所需的玻璃仪器有:滴管、玻璃棒、烧杯、量筒、干燥器、、、、、等(可填满,也可以空缺)。
(5)计算反应中生成的SO2和H2的体积之比:。
二氧化锰与浓盐酸混合加热得到氯气,如图是制取并探究Cl2化学性质的装置图。
(1)圆底烧瓶中发生反应的化学方程式为。
(2)若要得到干燥纯净的气体,B、C中应分别盛放的试剂为、。
(3)E中若装有FeCl2溶液,反应的离子方程式为,E中若装有淀粉碘化钾溶液,能观察到的实验现象是。
(4)实验中发现:浓盐酸与MnO2混合加热生成氯气,稀盐酸与MnO2混合加热不生成氯气。针对上述现象某化学兴趣小组对“影响氯气生成的原因”进行了讨论,并设计了以下实验方案:
a.稀盐酸滴入MnO2中,然后通入HCl气体加热
b.稀盐酸滴入MnO2中,然后加入NaCl固体加热
c.稀盐酸滴入MnO2中,然后加入浓硫酸加热
d.MnO2与NaCl的浓溶液混合加热
e.浓硫酸与NaCl固体、MnO2固体共热
①实验b的目的是,实验c的目的是。
②实验现象:a、c、e有黄绿色气体生成,b、d没有黄绿色气体生成。由此得出影响氯气生成的原因是 。
如图是某研究性学习小组设计制取氯气并以氯气为反应物进行特定反应的装置。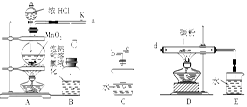
(1)要将C装置接入B和D之间,正确的接法是:a→→→d。
(2)实验开始先点燃A处的酒精灯,打开阀K,让Cl2充满整个装置,再点燃D处的酒精灯。Cl2通过C装置后进入D,D装置内盛有碳粉,发生氧化还原反应,生成CO2和HCl(g),发生反应的化学方程式为。
(3)D处反应完毕后,关闭阀K,移去两个酒精灯,由于余热的作用,A处仍有少量Cl2产生,此时B中的现象是,B的作用是。
(4)在A、B、C、D、E装置中有一处需要改进,说明需要改进的理由并画出改进后的装置图。
为了证明一氧化碳具有还原性,有人设计了下列实验: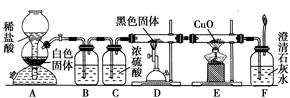
(1)装置B中最适宜的试剂是。
(2)装置D中发生反应的化学方程式是,。
(3)必须用装置C吸收除去气体中水蒸气的理由是,。
(4)若根据F中石灰水变浑浊的现象也能确定CO具有还原性,应在上图中装置与之间连接下列装置中的(填序号)。