下列关于化学反应方向的叙述中正确的是
| A.ΔH<0,ΔS>0的反应肯定是自发的 | B.ΔH<0,ΔS<0的反应肯定是自发的 |
| C.ΔH>0,ΔS>0的反应肯定是自发的 | D.ΔH>0,ΔS<0的反应肯定是自发的 |
下列物质①乙烷②乙炔③甲苯④苯⑤聚乙烯⑥对苯二酚⑦溴乙烷,其中既能与溴水反应又能与酸性高锰酸钾溶液反应的是
| A.②③④⑤ | B.②③④⑥⑦ | C.②⑥ | D.②⑤⑥ |
有机物中碳原子和氢原子个数比为3∶4,不能与溴水反应却能使KMnO4酸性溶液褪色。其蒸汽密度是相同状况下甲烷密度的7.5倍。在铁存在时与溴反应,能生成两种一溴代物,该有机物可能是
| A.CH≡C—CH3 | B.CH2=CHCH3 | C.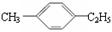 |
D.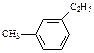 |
下列有关苯酚的实验事实中,能说明侧链对苯环性质有影响的是
| A.苯酚与浓溴水反应生成三溴苯酚 | B.苯酚能和NaOH溶液反应 |
| C.苯酚燃烧产生带浓烟的火焰 | D.1mol苯酚与3mol H2发生加成反应 |
目前,世界上已合成了几百种有机超导体,TCNQ是其中之一。TCNQ的分子结构如下图所示。下列关于TCNQ说法错误的为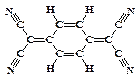
| A.分子中所有的氮原子在同一平面内 |
| B.属于芳香烃 |
| C.分子式为C12H4N4 |
| D.该物质难溶于水 |
有资料报道,前几年我国部分地区陆续发现了“毒油”。所谓“毒油”,是指混有汽油的食用油,不能食用.下列有关说法正确的是
| A.汽油是纯净物,有固定的熔、沸点 |
| B.汽油只能由石油分馏得到 |
| C.可用静置后看其是否分层来判断食用油中是否混有汽油 |
| D.汽油中烃分子内所含碳原子数为5~11 |