在恒容密闭容器中存在下列平衡:C(s)+H2O(g)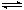 CO(g)+H2(g)。CO(g)的平衡物质的量浓度c(CO)与温度T的关系如右图所示。下列说法错误的是
CO(g)+H2(g)。CO(g)的平衡物质的量浓度c(CO)与温度T的关系如右图所示。下列说法错误的是
| A.该反应的ΔH>0 |
| B.若T1、T2时的平衡常数分别为K1、K2,则K1=K2 |
| C.通过加热可以使B点变到C点 |
| D.在T2时若反应进行到状态D,则一定有υ(正) <υ(逆) |
第四周期元素原子中未成对电子数最多可达()
| A.4个 | B.5个 | C.6个 | D.7个 |
下列有关电子云和原子轨道的说法正确的是()
| A.原子核外的电子象云雾一样笼罩在原子核周围,故称电子云 |
| B.s能级的原子轨道呈球形,处在该轨道上的电子只能在球壳内运动 |
| C.p能级的原子轨道呈纺锤形,随着电子层的增加,p能级原子轨道也在增多 |
| D.与s原子轨道的电子相同,p原子轨道电子的平均能量随能层的增大而增加 |
下列各原子或离子的电子排布式错误的是()
| A.K+:1s22s22p63s23p6 | B.F:1s22s22p5 |
| C.S2—:1s22s22p63s23p4 | D.Ar:1s22s22p63s23p6 |
按能量由低到高的顺序排列,正确的一组是()
| A.1s、2p、3d、4s | B.1s、2s、3s、2p |
| C.2s、2p、3s、3p | D.4p、3d、4s、3p |
在物质结构研究的历史上,首先提出原子内有电子学说的科学家是( )
| A.道尔顿 | B.卢瑟福 | C.汤姆生 | D.波尔 |