下述实验能达到预期目的的是
| 编号 |
实验内容 |
实验目的 |
| A |
将SO2通入溴水中 |
验证SO2具有漂白性 |
| B |
将乙醇与浓硫酸共热制得的气体直接通入酸性KMnO4溶液中 |
检验气体中含有乙烯 |
| C |
淀粉溶液和稀H2SO4混合加热,冷却后,再加新制的Cu(OH)2悬浊液加热至沸腾 |
检验淀粉水解产物有还原性 |
| D |
在滴有酚酞的Na2CO3溶液中,加入BaCl2溶液后红色褪去 |
验证Na2CO3溶液中存在水解平衡 |
某种药物主要成分X的分子结构如下: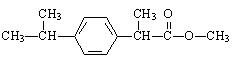
关于有机物X的说法中,错误的是()
| A.X难溶于水,易溶于有机溶剂 | B.X能跟溴水反应 |
| C.X能使酸性高锰酸钾溶液褪色 | D.X的水解产物不能发生消去反应 |
已知C5H11Cl共有8种同分异构体,可推知分子式为C5H12O醇(属醇类)的同分异构体的数目共有()
| A.9种 | B.6 种 | C.5种 | D.8种 |
根据下列反应步骤,由2-丙醇转化为1,2—丙二醇(HOCH2—CHOH—CH3)的正确的反应类型的顺序是()
| A.消去―取代―加成 | B.取代―消去―加成 |
| C.消去―加成―水解 | D.水解―取代―取代 |
只用水就能鉴别的一组物质是 ()
()
| A.苯、乙酸、四氯化碳 | B.乙醇、乙醛、乙酸 |
| C.乙醛、乙二醇、溴乙烷 | D.苯酚、乙醇、甘油[ |
据质谱图分析知某烷烃的相对分子质量为86,其核磁共振氢谱图有4个峰,峰面积比为6:4:3:1,则其结构简式为()
A. |
B.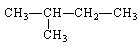 |
C.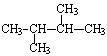 |
D.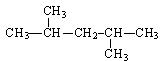 |