下列叙述中完全正确的是
| A.乙醇标准燃烧热的热化学方程式:C2H5OH(l)+3O2(g)=2CO2(g)+3H2O(g)△H=-1367.0 kJ/mol |
B.对于反应PCl5(g) PCl3(g)+Cl2(g),达到平衡后,若保持温度容器容积不变,又加入一定量的PCl5(g),则该平衡向正方向移动,但平衡时PCl5(g)的转化率减小 PCl3(g)+Cl2(g),达到平衡后,若保持温度容器容积不变,又加入一定量的PCl5(g),则该平衡向正方向移动,但平衡时PCl5(g)的转化率减小 |
| C.1.0mol/L的Fe(NO3)2溶液和2.0mol/L的HNO3溶液等体积混合后, c(NO3-)=2.0mol/L |
| D.1molCl2发生反应时,转移的电子数一定是2NA |
下列有关实验原理或实验操作正确的是()
| A.用pH试纸测定氯水的pH |
| B.过滤时为了加快过滤速度,可以用玻璃棒小心搅拌 |
C.选择合适的试剂,用右图所示装置可分别制取少量CO2和O2 |
| D.室温下向苯和苯酚的混合溶液中加入浓溴水,充分反应后过滤,可除去苯中少量苯酚 |
下列表示对应化学反应的离子方程式正确的是()
| A.漂白粉溶液中通入过量二氧化碳: Ca2++2ClO-+H2O+CO2=CaCO3↓+2HClO |
| B.NaOH溶液中滴人饱和FeCl3溶液: Fe3++3H2O 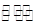 3H++3Fe(OH)3(胶体) 3H++3Fe(OH)3(胶体) |
C.将氯气溶于水配制氯水:Cl2+H2O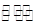 H++Cl-+HClO H++Cl-+HClO |
| D.用硫酸酸化的KMnO4溶液与H2O2反应: |
2MnO4-+10H++3H2O2=2Mn2++3O2↑+8H2O
X、Y、Z、M、W为五种短周期元素。X、Y、Z是原子序数依次递增的同周期元素,且最外层电子数之和为15;X与Z可形成XZ2分子;Y与M形成的气态化合物在标准状况下的密度为0.76g·L-1,W在短周期主族元素中原子半径最大。下列说法正确的是()
| A.原子半径:Z>Y>X |
| B.M2Z能与W的单质发生反应 |
| C.由X元素形成的单质一定是原子晶体 |
| D.由X、Y、Z、M四种元素形成的化合物一定既有离子键,又有共价键 |
下列各组离子在指定溶液中能大量共存的是()
①常温下,c(H+)/c(OH一)=1×10-12的溶液:K+、AlO2-、CO32-、Na+
②加入苯酚显紫色的溶液:K+、NH4+、Cl-、I一
③中性溶液:Fe3+、Al3+、NO3-、SO42-
④使pH试纸变蓝的溶液中:Al3+、Na +、SO42-、Cl一
+、SO42-、Cl一
⑤无色溶液中:K+、Al3+、NO3-、HCO3-
| A.②③ | B.①③ | C.① | D.①④⑤ |
化学在生产和日常生活中有着重要的应用。下列说法不正确的是()
| A.铁盐比铝盐更适合做净水剂 |
| B.光导纤维和石英玻璃主要成分都是二氧化硅 |
| C.MgO和Al2O3都可以做耐火材料 |
| D.合金一定比纯金属耐腐蚀 |