A、B、C、D四种短周期元素的原子半径依次减小,A 与C的核电荷数之比为3:4,D能分别与A、B、C形成电子总数相等的分子X、Y、Z。下列叙述正确的是
A.X、Y、Z的稳定性逐渐减弱
B.A、B、C、D只能形成5种单质
C.X、Y、Z三种化合物的熔沸点逐渐降低
D.自然界存在多种由A、B、C、D四种元素组成的化合物
如右图所示,在一U形管中装入含有紫色石蕊的Na2SO4试液,通直流电,一段时间后U形管内会形成一个倒立的三色“彩虹”,从左到右的颜色次序是( )
| A.蓝、紫、红 | B.红、蓝、紫 | C.红、紫、蓝 | D.紫、红、蓝 |
下图A为直流电源,B为浸泡过饱和氯化钠溶液和酚酞试液的滤纸,C为电镀槽。接通电路后发现B上的c点显红色。为实现铁上镀锌,接通K后,使c、d两点短路。下列叙述正确的是( )
| A.a为直流电源的负极 |
B.c极发生的反应为2H++2e- H2↑ H2↑ |
| C.f电极为锌板 |
| D.e极发生还原反应 |
工业上由二氧化锰制备高锰酸钾可分两步进行,第一步:二氧化锰与氢氧化钾共熔并通入氧气:2MnO2+4KOH+O2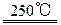 2K2MnO4+2H2O;第二步:电解锰酸钾溶液:2K2MnO4+2H2O
2K2MnO4+2H2O;第二步:电解锰酸钾溶液:2K2MnO4+2H2O 2KMnO4+H2↑+2KOH,下列说法正确的是( )
2KMnO4+H2↑+2KOH,下列说法正确的是( )
| A.氧化性:KMnO4>K2MnO4>O2 |
| B.根据上述过程,每生成1 mol KMnO4共转移6 mol电子 |
| C.第二步电解时,KMnO4在阳极区生成 |
| D.第二步电解时,阴极周围pH减小 |
关于电解NaCl水溶液,下列叙述正确的是( )
| A.电解时在阳极得到氯气,在阴极得到金属钠 |
| B.若在阳极附近的溶液中滴入KI溶液,溶液呈现棕色 |
| C.若在阴极附近的溶液中滴入酚酞试液,溶液呈现无色 |
| D.电解一段时间后,将全部电解液转移到烧杯中,充分搅拌后溶液呈现中性 |
用惰性电极电解未精制的饱和食盐水,食盐水装在U形管内,结果很快在某一电极附近出现食盐水变浑浊现象。造成浑浊的难溶物主要是( )
| A.碳酸镁 | B.硫酸钡 | C.氢氧化镁 | D.碳酸钡 |