运用元素周期律分析下面的推断,其中错误的是
| A.砹(At)为有色固体,HAt不稳定 |
| B.铊(T1)是铝的同族元素,原子核外有6个电子层,推测T1(OH)3是两性氢氧化物 |
| C.已知锶Sr与镁同族且原子半径大于钙,硫酸锶(SrSO4)是难溶于水的白色固体 |
| D.硒化氢(H2Se)比硫化氢稳定性差 |
某温度下,将Cl2通入KOH溶液中得KCl、KClO3和KClO的混合溶液。经测定ClO3-和ClO-物质的量之比为2:1,则反应中被还原的Cl2与被氧化Cl2的物质的量之比为 ( )
| A.2:3 | B.3:4 | C.11:3 | D.10:3 |
下列化学用语正确的是 ()
A. 的结构式: 的结构式: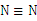 |
B.乙醇、乙酸和葡萄糖的实验式: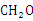 |
C.钠离子的结构示意图: |
D.次氯酸的电子式: |
将1mol H2(g) 和2mol I2(g) 置于某2L密闭容器中,在一定温度下发生反应:H2(g)+ I2(g)  2HI(g) ;△H<0,并达到平衡,HI的体积分数ω(HI)随时间变化如图(II)所示。若改变反应条件,ω(HI)的变化曲线如图所示,则改变的条件可能是 ( )
2HI(g) ;△H<0,并达到平衡,HI的体积分数ω(HI)随时间变化如图(II)所示。若改变反应条件,ω(HI)的变化曲线如图所示,则改变的条件可能是 ( )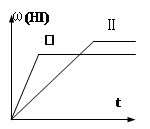
| A.恒温恒容条件下,加入适当催化剂 |
| B.恒温条件下,缩小反应容器体积 |
| C.恒容条件下升高温度 |
| D.恒温条件下,扩大反应容器体积 |
己知:HCN(aq)与NaOH(aq)反应的△H=-12.1kJ/mol;HCl(aq)与NaOH(aq)反应的△H= -55.6kJ/mol。则HCN在水溶液中电离的△H等于 ( )
| A.-67.7 kJ/mol | B.-43.5 kJ/mol |
| C.+43.5 kJ/mol | D.+67.7kJ/mol |
已知外电路中,电子由铜流向a极。有关下图所示的装置分析合理的一项是 
| A.该装置中Cu极为正极 |
| B.当铜极的质量变化为12 .8g时,a极上消耗的O2在标准状况下的体积为2.24L |
| C.b极反应的电极反应式为:H2-2e-=2H+ |
| D.一段时间后锌片质量减少 |