短周期金属元素甲~戊在元素周期表中的相对位置如表所示,下面判断正确的是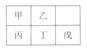
| A.原子半径:丙<丁<戊 | B.金属性:甲>丙 |
| C.氢氧化物碱性:丙>丁>戊 | D.最外层电子数:甲>乙 |
从化学试剂商店购买的某些试剂瓶上常贴有危险化学品的标志。盛装浓硝酸的试剂瓶上所贴的危险化学品标志是()
在蒸发皿中加热蒸干下列物质的溶液,再灼烧(溶液低于400℃)可以得到原溶质固体的是()
| A.AlCl3 | B.NaHCO3 | C.MgSO4 | D.KMnO4 |
相同条件下,同浓度的下列溶液,其pH值最大的是()
| A.Na2CO3 | B.CH3COONa | C.NaCl | D.NaHSO4 |
在CH3COOH溶液中存在如下平衡:CH3COOH H++CH3COO-。加入少量下列固体物质,能使平衡逆向移动的是()
H++CH3COO-。加入少量下列固体物质,能使平衡逆向移动的是()
| A.CH3COONa | B.NaCl | C.Na2CO3 | D.NaOH |
向纯水中加入少量下列物质或改变下列条件①稀硫酸 ②金属钠 ③氨气 ④FeCl3固体⑤NaClO固体 ⑥将水加热煮沸,能促进水的电离,并能使溶液中c(OH—)>c(H+)的操作是()
| A.②⑤ | B.①④ | C.③④⑥ | D.④ |