下列关于能源的研究方向合理的是
| A.研究提高化石能源的利用效率 |
| B.开发生物质能的利用新技术 |
| C.寻找有效催化剂使水在温和条件下光照分解 |
| D.以上都合理 |
Ⅰ.在甲溶液中通入过量CO2生成乙和另一种具有漂白性的物质,在乙溶液中滴加某钠盐溶液丙可以生成丁溶液(丁溶液呈中性),同时产生无色气体,已知题中所涉及的物质皆为中学化学中常见物质。回答下列问题:
(1)甲的化学式为 。
(2)写出乙在医疗上的一个用途 。
(3)在乙溶液中滴加丙溶液生成丁溶液的离子方程式 。
Ⅱ.固体化合物X由四种常见的短周期元素组成,可用作牙膏中的添加剂。现取39.3g化合物X进行如下实验: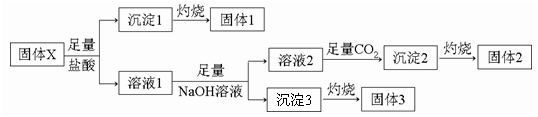
实验结束后得到15.3g固体2和6.0g固体3,且固体1、固体2、固体3都可用作耐高温材料。回答下列问题:
(1)NaOH的电子式为 ,沉淀2的化学式为 。
(2)固体X的化学式为 。
(3)溶液1中加入足量NaOH溶液,反应的化学方程式为 。
(4)在高温下,固体3中某元素的单质可以与固体1发生置换反应,请写出此反应的化学方程式 。
(5)设计一个实验方案,比较固体2和固体3中两不同元素对应单质的活动性强弱 。
【化学—选修5有机化学基础】某芳香烃A是有机合成中非常重要的原料,通过质谱法测得其最大质荷比为118;其核磁共振氢谱中有5个峰,峰面积之比为1:2:2:2:3;其苯环上只有一个取代基。以下是以A为原料合成高分子化合物F、I的路线图,试回答下列问题: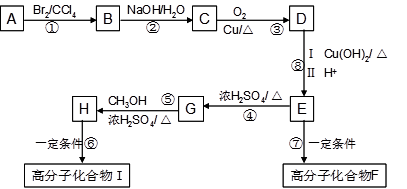
(1)A的结构简式为 。
(2)D中的官能团名称是 。
(3)I的结构简式为 。
(4)上述反应中属于取代反应的是 。
(5)反应⑥、⑦生成的高分子化合物的反应原理是否相同 。
(6)写出下列反应的化学方程式:
反应⑤ ;反应⑦ 。
(7)符合以下条件的D的同分异构体有 种(不考虑立体异构)。
| A.苯环上有两个取代基 | B.苯环上的一氯代物有两种 |
| C.加入三氯化铁溶液不显色 | D.能发生银镜反应 |
【化学—选修3物质结构与性质】前四周期原子序数依次增大的六种元素M、A、B、C、D、E中,M、A的最高化合物与最低化合价的绝对值相等,A形成的化合物种类最多,A、B属于同一短周期元素且相邻, C、D、E是位于同一周期的金属元素,基态C原子的价电子层中未成对电子为1个,基态D、E原子的价电子层中未成对电子数分别为4、2,且原子序数相差为2。
(1)六种元素中第一电离能最小的是 (填元素符号,下同),其原子结构示意图是______。
(2)M与B元素形成的化合物空间构型是_____,在实验室制取该物质的方法是 (用化学反应方程式表示),收集方法是_______;
(3)E的价层电子排布图为 ,未成对的电子数是______;很多不饱和有机物在E催化下可与H2发生加成反应:如①CH2=CH2、②HC≡CH、③ 、④HCHO。
、④HCHO。
其中碳原子采取sp2杂化的分子有 (填物质序号),HCHO分子的立体结构为 形,它加成产物的熔、沸点比CH4的熔、沸点高,其主要原因是(须指明加成产物是何物质) 。
(4)金属C晶体的晶胞结构如图。C晶体晶胞中金属原子的配位数之比为 。在一个晶胞中含有C原子是_____个。氧化镍(NiO )是一种纳米材料,比表面积S(m2/g)是评价纳米材料的重要参数之一(纳米粒子按球形计)。已知氧化镍的密度为ρg/cm3;其纳米粒子的直径为Dnm列式表示其比表面积 m2/g。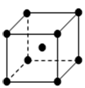
【化学—选修2化学与技术】实验室里用硫酸厂烧渣(主要成分为铁的氧化物及少量FeS、SiO2等)制备硫酸、聚铁(碱式硫酸铁的聚合物)和绿矾(FeSO4·7H2O),其过程如下:
请回答下列问题:
(1)过程①中,加快反应速率的方法有 。FeS和O2、H2SO4反应的化学方程式是____________。
(2)过程②中产生的气体可用于氧化产生硫酸,为使SO2尽快、尽多的转化为SO3,可采取的措施是_____(填字母)
A.高温、高压 B.适当温度、催化剂
C.通入过量的氧气 D.低温、低压
产生的尾气会对大气造成污染,可选用下列试剂中的_________吸收(填字母)。
A.浓H2SO4B.蒸馏水 C.NaOH溶液D.浓硝酸
(3)过程③中,需要加入的物质名称是_______。反应的离子方程式是________。
(4)过程④中的实验操作是__________________________。
(5)过程⑥中,将溶液Z加热到70~80℃,目的是__________________________。
(6)实验室为测定所得到的聚铁样品中铁元素的质量分数,进行下列实验:①用天平称取样品5.35g;②将样品溶于足量硝酸酸化后,再加入足量的氯化钡溶液;③过滤、洗涤、干燥,称量,得固体质量为6.99g。若该聚铁主要成分为[Fe(OH) SO4]n,则该聚铁中铁元素的质量分数为_____________(精确至0.01%)。
CO的应用和治理问题属于当今社会的热点问题。
(1)在实验室中以甲酸和浓硫酸混合加热制取CO,该反应的方程式是:__________;
(2)HCOOH的酸性略强于醋酸,是实验室制取CO的主要试剂,在0.1mol/L HCOOH溶液中,溶质分子和各种离子浓度由大到小的顺序为 。常温下,将0.2mol/L HCOOH和0.1mol/LNaOH溶液等体积混合,所得溶液的pH<7,说明HCOOH的电离程度________HCOONa的水解程度(填“大于”或“小于”)。该溶液中c(HCOOH)-c(OH-) +c(H+)=______mol/L
(3)已知:硫的燃烧热为296 kJ/mol;一氧化碳燃烧热为283 kJ/mol。为防止镍系催化剂中毒,工业上常用SO2除去原料气中少量CO,生成物为固体S和CO2。该反应的热化学方程式为 。
(4)光气(COCl2)是一种重要的化工原料,用于农药、医药、聚酯类材料的生产,工业上通过Cl2(g)+CO(g) 
 COCl2(g)制备。左图为此反应的反应速率随温度变化的曲线,如图为某次模拟实验研究过程中容器内各物质的浓度随时间变化的曲线。回答下列问题:
COCl2(g)制备。左图为此反应的反应速率随温度变化的曲线,如图为某次模拟实验研究过程中容器内各物质的浓度随时间变化的曲线。回答下列问题: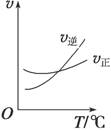
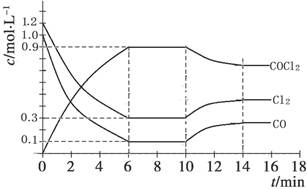
①0~6 min内,反应的平均速率v(COCl2)= ;
②若保持温度不变,在第8 min 加入体系中的三种物质各3mol,则平衡 移动(填“向正反应方向”、“向逆反应方向”或“不移动”);
③在恒温恒压条件下,若将初始投料浓度变为c(Cl2)=amol/L、c(CO)=bmol/L、c(COCl2)=cmol/L,(a、b、c都大于0)则最终达到化学平衡时,Cl2的体积分数与上述第6 min时Cl2的体积分数相同,则a、b、c三种物质的关系是________
④随温度升高,该反应平衡常数变化的趋势是 。(填“增大”、“减小”或“不变”)