400℃时,向容积为2L的密闭容器中充入1.2 mol 的A和0.6mol 的B,发生反应如下:A(g)+B(g)  C(g)+D(g)。t分钟后反应达到平衡,此时测得A的物质的量为0.8 mol。下列说法正确的是
C(g)+D(g)。t分钟后反应达到平衡,此时测得A的物质的量为0.8 mol。下列说法正确的是
A.反应在tmin内的平均速率为v(D)=0.4/t mol·L-1·min-1
B. 温度升至500℃时,上述反应平衡常数为0.64,则正反应为吸热反应
C.保持其他条件不变,向平衡体系中再通入0.2molB,与原平衡相比,达到新平衡时A转化率增大,B的体积分数增大
D. 若反应开始时向密闭容器中充入2.4 mol 的A和1.2mol 的B,达到平衡所需时间小于t
氧化还原反应与四种基本反应类型的关系如图所示。下列化学反应属于阴影部
的是
| A.2Na2O2+2CO2→2Na2CO3+O2 |
B.2NaHCO3  Na2CO3+H2O+CO2↑ Na2CO3+H2O+CO2↑ |
| C.4Fe(OH)2+O2+2H2O→4Fe(OH)3 |
| D.Cl2+2KBr→Br2+2KCl |
“节能减排”是可持续发展的一项重要举措。下列图标中,属于节能标志的是
阿伏加德罗常数为NA,下列说法正确的是( )
| A.1 mol钠与氧气反应生成Na2O或Na2O2时,失电子数目均为NA |
| B.1 mol Na2O2与足量CO2反应时,转移2NA个电子 |
| C.1 mol/L的NaOH溶液中含Na+数目为NA |
| D.1 mol Na2O2中含有的阴离子数目为2NA |
常温下,将0.1 mol的金属钠、镁、铝分别投入到100 mL 0.5 mol/L的盐酸中,完全反应后产生的氢气是( ).
| A.钠、镁、铝一样多 | B.钠放出的多 |
| C.镁放出的多 | D.铝放出的多 |
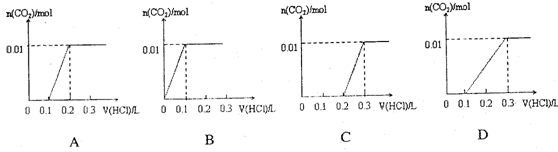
将0.4gNaOH和1.06g Na2CO3混合并配成溶液,向溶液中滴加0.1mol·L-1稀盐酸。下列图像能正确表示加入盐酸的体积和生成CO2的物质的量的关系的是()