(1)室温下,在pH=12的某种溶液中,由水电离的c(OH-)为 。
(2)等体积的下列溶液中,阳离子的总物质的量最大的是 。
①0.2 mol·L-1的CuSO4溶液 ②0.1 mol·L-1的Na2CO3
③0.2 mol·L-1的KCl ④0.1 mol·L-1的Na2SO4
(3)浓度为0.100 mol·L-1的下列各物质的溶液中,c(NH4+)由大到小的顺序是 。
①NH4Cl ②NH4HSO4 ③NH3·H2O ④CH3COONH4
已知五种元素的原子序数的大小顺序为C>A>B>D>E,A、C同周期,B、C同主族。A与B形成离子化合物A2B,A2B中所有离子的电子数相同,其电子总数为
30;D和E可形成4核10个电子分子。试回答下列问题:
(1)写出下列元素的元素名称:A_____、C______。
(2)用电子式表示离子化合物A2B的形成过程:。
(3)写出D元素形成的单质的结构式;D与E形成的化合物的电子式。
(4)实验室制取D的氢化物的化学方程式。
(5)A、B两元素组成的化合物A2B2属于(“离子”或“共价”)化合物,
存在的化学键是。
下表是元素周期表的一部分,请回答有关问题:
|
ⅠA |
ⅡA |
ⅢA |
ⅣA |
ⅤA |
ⅥA |
ⅦA |
0 |
||||||
| 2 |
① |
② |
③ |
|||||||||||
| 3 |
④ |
⑤ |
⑥ |
⑦ |
⑧ |
|||||||||
| 4 |
⑨ |
⑩ |
(1)表中化学性质最不活泼的元素,其原子结构示意图为 。
(2)表中能形成两性氢氧化物的元素是 (用元素符号表示),写出该元素的
单质与⑨最高价氧化物的水化物反应的离子方程式 。
(3)④元素与⑦元素形成化合物的电子式 。
(4)①、②、⑥、⑦四种元素的最高价氧化物的水化物中酸性最强的是 (填化学式)。
(5)③元素与⑩元素两者核电荷数之差是 。
(6)设计实验方案:比较⑦与⑩单质氧化性的强弱,请将方案填入下表。
| 实验步骤 |
实验现象与结论 |
除去下列物质中的杂质(括号内),填入所用试剂和分离方法或化学方程式。
(1)乙烯(SO2):试剂,分离方法
(2)苯(溴):试剂,分离方法
(3)乙烷(乙烯)试剂,化学方程式
下面列出了几组物质,请将物质的合适组号填写在空格上。同位素,同系物,同分异构体,同素异形体。
①金刚石与“足球烯”C60;②D与T;③16O、17O和18O;
④氧气(O2)与臭氧(O3);⑤CH4和CH3CH2CH3;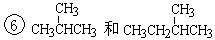 ;
;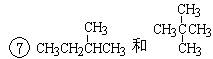
(14分)向体积为 2L 的固定密闭容器中通入3molX 气体 , 在一定温度下发生如下反应:2X (g) Y (g) +3Z (g)
Y (g) +3Z (g)
(1). 经 5min 后反应达到平衡 , 此时测得容器内的压强为起始时的 1.2 倍 , 则用 Y 表示的速率为mol/L·min。
(2)若上述反应在甲、乙、丙、丁四个同样的密闭容器中进行 , 在同一段时间内测得容器内的反应速率分别为 : 甲、 v (X) ="3." 5 mol/L·min; 乙、 v (Y) ="2" mol/L·min; 丙、 v (Z) ="4." 5 mol/L·min; 丁、 v (X) ="0." 075 mol/L·s。若其它条件相同 , 温度不同 , 则温度由高到低的顺序是 ( 填序号〉
(3) 若向达到 (1) 的平衡体系中充入惰性气体, 则平衡向( 填"左"或"右"或"不)移动;若向达到 (1) 的平衡体系中移走部分混合气体 , 则平衡向( 填 " 左 " 或 " 右 " 或 " 不 ") 移动。
(4)若在相同条件下向达到 (1) 所述的平衡体系中再充入 0.5molX 气体 , 则平衡后 X 的转化率与(1) 的平衡中的 X 的转化率相比较
| A.无法确定 | B.前者一定大于后者 | C.前者一定等于后者 | D.前者一定小于后者 |
(5)若保持温度和压强不变 , 起始时加入 X 、 Y 、 Z 物质的量分别为 amol 、 bmol 、 cmol, 达到平衡时仍与 (1) 的平衡等效 , 则 : a 、b 、c应该满足的关系为
(6)若保持温度和体积不变 , 起始时加入 X 、 Y 、 Z 物质的量分别为 amol 、 bmol 、 cmol, 达到平衡时仍与 (1) 的平衡等效 , 且起始时维持化学反应向逆反应方向进行 , 则c 的取值范围应该为