下列物质中含有共价键的离子化合物是
| A.Ba (OH)2 | B.CaCl2 | C.H2 SO4 | D.NH4Cl |
下列物质属于盐的是
| A.铁红 | B.干冰 | C.熟石灰 | D.纯碱 |
某硫酸厂拟用烟气处理含Cr2O72-的酸性废水,在脱硫的同时制备Cr2O3产品。具体流程如下: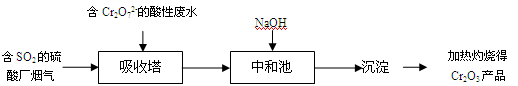
已知吸收塔中反应后的铬元素以Cr3+形式存在,下列说法中正确的是
| A.吸收塔中的硫元素可能以单质形式存在 |
| B.中和池中只发生生成沉淀的复分解反应 |
| C.在中和池中加入盐酸酸化的BaCl2溶液,可能产生白色沉淀 |
| D.由题意分析得到,沉淀可能是Cr(OH)6 |
火法炼铜的原理为:Cu2S + O2 高温 2Cu + SO2,下列说法中,正确的是
| A.Cu2S只作还原剂 |
| B.该反应中的氧化剂只有O2 |
| C.Cu2S 中的Cu元素被S元素还原 |
| D.当1 mol O2参加反应时,共转移4 mol e- |
下列说法正确的是
| A.1 mol H2所占体积约为22.4 L |
| B.22 g CO2中含有的分子数约为6.02×1023 |
| C.100 mL 0.5 mol/L NaOH溶液中含溶质的质量为0.05 g |
| D.标准状况下,11.2 L O2和H2的混合气体所含分子数约为3.01×1023 |
下列关于H2SO3溶液的说法正确的是
| A.能使酸性高锰酸钾溶液褪色是因为H2SO3的漂白性 |
| B.H2SO3在空气中容易变质,成为SO2 |
| C.溶液中存在的微粒只有H+和SO32- |
| D.能与NaOH溶液发生复分解反应 |