下列说法正确的是
| A.只有反应体系中所有分子同时都发生有效碰撞的反应才是放热反应 |
| B.通常条件下能够自发进行的反应必须具备△H和△S均大于0 |
| C.任何化学反应只要是自发进行的放热反应都可以设计成原电池,为外界提供电能 |
| D.实验室通常将固态氯化铁溶解在盐酸中,再稀释到相应浓度来配置氯化铁溶液 |
短周期元素甲、乙、丙、丁的原子序数依次增大;甲和乙形成的化合物常温下是气体,其水溶液呈碱性;甲和丙同主族;丁原子最外层电子数与电子层数相等。下列叙述中正确的是
| A.原子半径:丙>乙>丁 |
| B.单质的还原性:丁>丙>甲 |
| C.甲、乙、丙的氧化物均为共价化合物 |
| D.乙、丙、丁的最高价氧化物对应水化物能相互反应 |
已知:正四面体形分子E和直线形分子G反应,生成四面体形分子L和直线形分子M(组成E分子的元素的原子序数均小于10,组成G分子的元素为第三周期元素)。
下列判断中正确的是
| A.常温常压下,L是一种液态有机物 |
| B.E的二溴代物只有一种结构 |
| C.G具有强氧化性和漂白性 |
| D.上述反应的类型是加成反应 |
X、Y、Z、M为4种短周期元素,X、Y位于同周期且原子半径r(X)>r(Y), Y2-与M+的电子层结构相同,X与Z的原子核外最外层电子数相同,Z的单质可制成半导体材料。下列说法不正确的是
| A.单质M的晶体是体心立方堆积,M的配位数是8 |
| B.XY2、ZY2、M2Y的晶体分别属于3种不同类型的晶体 |
| C.X的氢化物X2H2分子中含有2个σ键和2个π键 |
| D.由元素X与Z形成的化合物中只含共价键 |
W、X、Y、Z是四种常见的短周期主族元素,其原子半径随原子序数的变化如下图所示。已知Y、Z两种元素的单质是空气的主要成分,W原子的最外层电子数与Ar原子的最外层电子数相差1。下列说法正确的是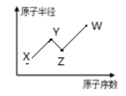
| A.第一电离能:Y>Z |
| B.Y、W的最简单氢化物的水溶液都呈酸性 |
| C.W单质的水溶液具有漂白性 |
| D.W的单质可从Z的简单氢化物种置换出Z的单质 |
下列有关分子的结构和性质的说法中正确的是
| A.PCl3和SO2都是极性分子 |
| B.H2O是一种非常稳定的化合物,这是由于氢键所致 |
| C.BF3、NCl3分子中所有原子的最外层电子都满足8电子稳定结构 |
| D.凡是中心原子采取sp3杂化轨道形成的分子其几何构型都是正四面体 |