其他条件不变的情况下,下列说法不正确的是
A. 对于反应nA(g)+B(g)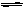 2C(g),平衡后增大压强,A的百分含量减小,则n≥2。
2C(g),平衡后增大压强,A的百分含量减小,则n≥2。
B. 对于反应2A(g)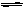 B(g) △H<0,若体系温度不再变化说明反应达到平衡状态。
B(g) △H<0,若体系温度不再变化说明反应达到平衡状态。
C.对于反应2A(g)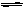 B(g),恒温,恒容条件下气体密度不再变化,说明反应达到平衡状态
B(g),恒温,恒容条件下气体密度不再变化,说明反应达到平衡状态
D.对于反应2A(g)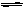 B(g),若v(A)正=2v(B)逆,说明反应达到平衡状态
B(g),若v(A)正=2v(B)逆,说明反应达到平衡状态
某温度时,AgCl在水中的沉淀溶解平衡曲线如图所示(提示:Ag Cl(s)
Cl(s) Ag+(aq)+Cl-(aq),其平衡常数Ksp=c(Ag+)·c(Cl-),称为溶度积常数;又知:
Ag+(aq)+Cl-(aq),其平衡常数Ksp=c(Ag+)·c(Cl-),称为溶度积常数;又知:
Ksp(AgCl)=1.8×10-10,Ksp(Ag2S)=6.3×10-50)。下列说法正确的是: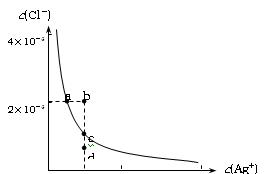
| A.加入NaCl可以使溶液由a点变到b点 |
| B.b点和d点均无AgCl沉淀生成 |
| C.a点对应的Ksp大于c点对应的Ksp |
D.向0.1mol/L的硝酸银溶液中滴加0.1mol/L的NaCl溶液至不再有白色沉淀生成,再向其中滴加0.1mol/L的Na2S溶液,白色沉淀转化为黑色沉淀。其沉淀转化的反应方程式为:2AgCl(s)+S2-(aq) Ag2S(s)+2Cl-(aq) 。 Ag2S(s)+2Cl-(aq) 。 |
下列叙述正确的是
| A.c(NH)相等的(NH4)2SO4溶液、(NH4)2Fe(SO4)2溶液和NH4Cl溶液中,溶质浓度大小关系是:c[(NH4)2Fe(SO4)2]<c[(NH4)2SO4]<c(NH4Cl) |
| B.0.1 mol·L-1的CH3COOH溶液加水稀释,溶液中c(OH-)减小 |
| C.0.2 mol·L-1 HCl溶液与等体积0.05 mol·L-1 Ba(OH)2溶液混合后,溶液的pH=1 |
| D.0.2 mol·L-1的NaHCO3溶液中c(H+)+c(H2CO3)=2c(CO)+c(OH-) |
在下图中的8个装置中, 属于原电池的是
属于原电池的是
| A.①④⑤ | B.③⑥⑧ | C.④⑥⑦ | D.⑥⑦⑧ |
把A、B、C、D四块金属片浸入稀硫酸中, 分别用导线两两相连可以组成原电池。A、B相连时A为负极;C、D相连时,电流由D→C;A、C相连时,C极上产生大量气泡,B、D相连时,D极发生氧化反应。这四种金属的活动性顺序是
分别用导线两两相连可以组成原电池。A、B相连时A为负极;C、D相连时,电流由D→C;A、C相连时,C极上产生大量气泡,B、D相连时,D极发生氧化反应。这四种金属的活动性顺序是
A.A>B>C>D B.A>C>D>B C.C>A>B>D D.B>D>C>A
用铁与稀硫酸反应制取氢气时,下列措施不能使氢气的生成速率加快的是
| A.加热 | B.改用98%的浓硫酸 | C.不用铁片,改用铁粉 | D.增大压强 |