已知甲、乙溶质的质量分数与溶液密度的关系如下表所示:
| 溶质的质量分数 |
甲溶液密度╱g·cm-3 |
乙溶液密度╱g·cm-3 |
| 1% |
0.95 |
1.02 |
| 5% |
0.92 |
1.04 |
| 9% |
0.90 |
1.07 |
甲物质的1%的溶液与9%的溶液等体积混合,乙物质的1%的溶液与9%的溶液等体积混合,下列叙述中,正确的是
A.混合后,甲、乙溶液中溶质的质量分数均大于5%
B.混合后,乙溶液中溶质的质量分数大于5%,甲溶液中溶质的质量分数小于5%
C.混合后,甲溶液中溶质的质量分数大于5%,乙溶液中溶质的质量分数小于5%
D.混合后,甲、乙溶液中溶质的质量分数均等于5%
电导率可用于衡量电解质溶液导电能力的大小。室温下,用0.100 mol·L-1 NH3·H2O滴定10 mL浓度均为0.100 mol·L-1HCl和CH3COOH的混合液,电导率曲线如图所示。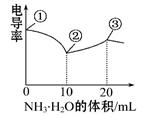
下列说法正确的是
| A.①溶液中c(H+)为0.200 mol·L-1 |
| B.溶液温度高低为①>③>② |
| C.③点溶液中有c(Cl—)>c(CH3COO—) |
| D.③点后因离子数目减少使电导率略降低 |
如图装置中,在U形管底部盛有CCl4,分别在U形管两端小心倒入饱和食盐水和稀硫酸溶液,并使a、b两处液面相平,然后分别塞上插有生铁丝的塞子,密封好,放置一段时间后,下列有关叙述中错误的是
| A.铁丝在两处的腐蚀速率:a < b |
| B.a、b两处相同的电极反应式为Fe-2e-==Fe2+ |
| C.一段时间后,a处液面高于b处液面 |
| D.生铁丝中的碳在a、b两处分别作原电池的负极和正极 |
为了探索外界条件对反应aX(g)+bY(g) cZ(g)的影响,以X和Y物质的量之比为a∶b开始反应,通过实验得到不同条件下达到平衡时Z的物质的量分数,实验结果如下图所示。
cZ(g)的影响,以X和Y物质的量之比为a∶b开始反应,通过实验得到不同条件下达到平衡时Z的物质的量分数,实验结果如下图所示。
下列判断正确的是
| A.ΔH>0 a+b>c | B.ΔH<0 a+b<c |
| C.ΔH<0 a+b>c | D.ΔH>0 a+b<c |
“类推”是一种在化学学习中常用的方法,下列类推结论中正确的是
| A.ⅣA族元素氢化物熔点顺序:GeH4>SiH4>CH4;则ⅥA族元素氢化物熔点顺序也应为:H2Se>H2S>H2O |
| B.第2周期元素氢化物的稳定性顺序是HF>H2O>NH3;则第3周期元素氢化物的稳定性顺序也是HCl>H2S>PH3 |
| C.工业上用电解熔融的氯化镁制备镁单质,工业上也可用电解熔融的氯化铝制备铝单质 |
| D.BaCl2溶液中通入SO2无沉淀产生,则Ba(NO3)2溶液中通入SO2也无沉淀产生 |
固体硝酸盐加热易分解且产物较复杂。某学习小组以Mg(NO3)2为研究对象,拟通过实验探究其热分解的产物,提出如下4种猜想,其中一定不成立的是
| A.Mg(NO2)2、NO2、O2 | B.MgO、NO2、O2 |
| C.Mg3N2、O2 | D.MgO、NO2、N2 |