在托盘天平两端的烧杯中加入同浓度同体积的足量盐酸,当向两个烧杯中分别加入0.1mol两种金属充分反应后,而在某一端要再放一个0.2g砝码,天平才能平衡,则这两种金属是
| A.Mg和Al | B.Al和Fe | C.Fe和Cu | D.Na和Mg |
有一瓶Na2SO3溶液,由于可能已部分氧化,某学生进行如下实验:取少量溶液,滴入Ba(NO3)2溶液产生白色沉淀,再加入过量稀硝酸,充分振荡后仍有白色沉淀,结论正确的是
| A.Na2SO3溶液已部分氧化 |
| B.加入Ba(NO3)2溶液后生成的沉淀中一定含有BaSO4 |
| C.加硝酸后的不溶沉淀一定为BaSO4 |
| D.此实验能确定Na2SO3溶液是否部分氧化 |
对下列实验现象的原因分析不正确的一项是
| 选项 |
实验现象 |
原因分析 |
| A |
浓硫化钠溶液有臭味 |
硫离子水解生成硫化氢,硫化氢具有臭味 |
| B |
新制氯水中滴加石蕊试液,溶液先变红,后褪色 |
氯气与水反应生成HCl、HClO,HCl显强酸性,使石蕊变红,HClO具有强氧化性,使其褪色 |
| C |
SO2通入溴水中,溴水褪色 |
SO2具有漂白性,使其褪色 |
| D |
向湿润蔗糖中加入浓硫酸,固体迅速变黑,后体积急剧膨胀 |
在浓硫酸脱水作用下,蔗糖被炭化,炭与浓硫酸反应生成了CO2、SO2 |
在某无色溶液中缓慢地滴入NaOH溶液直至过量,产生沉淀的质量与加入的NaOH溶液体积的关系如右图所示,由此确定,原溶液中含有的阳离子可能是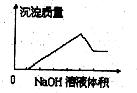
| A.Mg2+、Al3+、Fe3+ | B.Na+、Mg2+、Al3+ |
| C.H+、Ba2+、Al3+ | D.H+、Mg2+、Al3+ |
“混盐”是指一种金属离子与多种酸根离子构成的盐,如氯化硝酸钙[Ca(NO3)Cl]就是一种混盐。“复盐 ”是指含有多种简单阳离子和一种酸根阴离子的盐如KAl(SO4)2,下列各化合物中属于混盐的是
| A.CaOCl2 | B.(NH4)2Fe(SO4)2 |
| C.BiONO3 | D.K3[Fe(CN)6] |
所谓合金,就是不同种金属(也包括一些非金属)在熔化状态下形成的一种熔合物,根据下列四种金属的熔沸点:
| Na |
Cu |
Al |
Fe |
|
| 熔点(0C) |
97.5 |
1083 |
660 |
1535 |
| 沸点(0C) |
883 |
2595 |
2200 |
3000 |
你判断其中不能形成合金的是
A.Cu和Al B.Fe和CuC.Fe和Na D.Al和Na