在一定温度和压强下,向盛有足量X的体积可变的密闭容器中通入Y气体,发生反应:X(s)+aY(g) bZ(g)+W(g);△H>0,平衡时Z的物质的量与通入Y的物质的量的变化关系如图所示。下列说法中正确的是
bZ(g)+W(g);△H>0,平衡时Z的物质的量与通入Y的物质的量的变化关系如图所示。下列说法中正确的是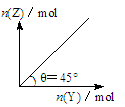
| A.平衡时Y的转化率为×100% |
| B.向容器中再加入少量X,则Y的转化率增大 |
| C.再通入Y,重新达到平衡时W的体积分数不变 |
| D.保持压强一定,当原反应在较高温度下建立平衡时,图中θ<45° |
某有机物的结构简式如下图,该物质不应有的化学性质是( )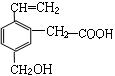
①可燃烧;
②可跟溴加成;
③可使酸性KMnO4溶液褪色;
④可跟NaHCO3溶液反应;
⑤可跟NaOH溶液反应;
⑥可在碱性条件下水解
| A.①③ | B.③⑥ | C.④⑤ | D.⑥ |
甲苯(C7H8)和甘油(C3H8O3)组成的混合物中,若碳元素的质量分数为60%,那么可以推断氢元素的质量分数约为()
| A.5% | B.8.7% | C.17.4% | D.无法计算 |
下列说法错误的是()
| A.同系物一定符合同一通式 |
| B.同分异构体一定具有相同的最简式 |
| C.一种元素形成的不同物质可能互为同分异构体 |
| D.同系物的化学性质相似,物理性质随着碳原子数增加而有规律的变化 |
已知可逆反应:N2(g)+3H2(g) 2NH3(g)△H=-92kJ·mol-1下列关于此反应的说法中错误的是
2NH3(g)△H=-92kJ·mol-1下列关于此反应的说法中错误的是





 ( )
( )
| A.加压可使该反应的反应速率变大 |
| B.该反应中反应物的总能量比生成物的总能量高 |
| C.将1molN2和3molH2混合进行反应,反应完成时放出的热量为92kJ |
| D.单位时间内生成1molN2,同时消耗3molH2说明该反应达到平衡状态 |
短周期主族元素A、B、C、D,原子序数依次增大。A、C的原子序数的差为8,A、B、C三种元素原子的最外层电子数之和为15,B原子最外层电子数等于A原子最外层电子数的一半。下列叙述正确的是( )
A.原子半径:A<B<C<D B.非金属性:C>A
C.最高价氧化物对应水化物的酸性:D>C D.单质B常温下能溶于浓硝酸