(9分)氮化钠(Na3N)是科学家制备的一种重要化合物,它与水作用可产生NH3,请回答:
(1)Na3N的电子式__________________,该化合物是由______________键形成。
(2)Na3N与水反应方程式为____________________________________________,该反应属___________________(填基本反应类型)反应。
(3)Na3N放入足量盐酸中生成_______种盐,其化学式为__________________。
(4)比较Na3N中两种粒子的半径:r(Na+)___r(N3-)(填“>”“=”或“<” )
(14分)硫—碘循环分解水制氢主要涉及下列反应: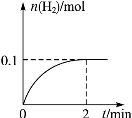
Ⅰ SO2+2H2O+I2===H2SO4+2HI
Ⅱ 2HI H2+I2
H2+I2
Ⅲ 2H2SO4===2SO2+O2+2H2O
(1)分析上述反应,下列判断正确的是______。
a.反应Ⅲ易在常温下进行
b.反应Ⅰ中SO2氧化性比HI强
c.循环过程中需补充H2O
d.循环过程中产生1 mol O2的同时产生1 mol H2
(2)一定温度下,向1 L密闭容器中加入1 mol HI(g),发生反应
2HI H2+I2,H2物质的量随时间的变化如图所示。0~2 min内的平均反应速率v(HI)=__________。该温度下,H2(g)+I2(g)
H2+I2,H2物质的量随时间的变化如图所示。0~2 min内的平均反应速率v(HI)=__________。该温度下,H2(g)+I2(g) 2HI(g)的平衡常数K=______。相同温度下,若开始加入HI(g)的物质的量是原来的2倍,则______是原来的2倍。
2HI(g)的平衡常数K=______。相同温度下,若开始加入HI(g)的物质的量是原来的2倍,则______是原来的2倍。
a.平衡常数 b.HI的平衡浓度
c.达到平衡的时间 d.平衡时H2的体积分数
(3)实验室用Zn和稀硫酸制取H2,反应时溶液中水的电离平衡______移动(填“向左”“向右”或者“不”);若加入少量下列试剂中的______,产生H2的速率将增大。
a.NaNO3 b.CuSO4c.Na2SO4 d.NaHSO3
(4)以H2为燃料可制成氢氧燃料电池。
已知2H2(g)+O2(g)===2H2O(l) ΔH=-572 kJ·mol-1。某氢氧燃料电池释放228.8 kJ电能时,生成1 mol液态水,该电池的能量转化率为________。
(8分)晶体具有规则的几何外形,晶体中最基本的重复单元称之为晶胞。NaCl晶体结构如右图所示。 随着科学技术的发展,测定阿伏加德罗常数的手段越来越多,测定精确度也越来越高。现有一简单可行的测定方法,具体步骤如下:①将固体食盐研细,干燥后,准确称取m gNaCl固体并转移到定容仪器A中。②用滴定管向仪器A中加苯,并不断振荡,继续加苯至A仪器的刻度线,计算出NaCl固体的体积为VmL。回答下列问题:
(1)步骤①中A仪器最好用__________________(填序号)。
| A.量筒 | B.烧杯 | C.容量瓶 | D.试管 |
(2)步骤②中是用酸式滴定管还是用碱式滴定管
(3)经X射线衍射测得NaCl晶胞中最邻近的Na+ 和Cl-平均距离为a cm,则利用上述方法测得的阿伏加德罗常数的表达式为NA=_________。
(4)纳米材料的表面原子占原子数的比例很大,这是它具有许多特殊性质的原因,假设某氯化钠纳米颗粒的形状恰好类似氯化钠晶胞,其大小为氯化钠晶胞大小的8倍,
则这种纳米颗粒的表面原子占总原子数的百分比为_____________(保留一位小数)。
(15分)现有aA、bB、cC、dD、eE、fF五种短周期元素,它们都是生命体不可缺少的重要元素。已知它们的原子序数有如下关系:a+b=c,a+c=d,a+d="e" ,d+e=f,C、E、F都有多种同素异形体。人类已知的化合物中,有一类化合物的种类已超过三千万种,这类化合物中一般都含有A、C两种元素。根据以上信息回答下列有关问题:
(1)元素F的电子排布式:_______________
(2)由A、B、D形成的化合物N和苯互为等电子体,则N的结构式为_____________
(3)A和E按原子个数比1 : 1形成的化合物是______________分子(填极性和非极性)
(4)写出由A、C、D、E四种元素组成的离子化合物和共价化合物的化学式(各写出1种即可) _____________________ 、
(5)在A、C、E三种元素中选择2种或3种元素,组成2种可发生反应的阴离子,请写出该反应的离子方程式:___________________________________________。
(6)B和D按原子个数比1 : 1形成的化合物有两种,一种为质地较软的P,一种为质地坚硬的Q,P的结构和石墨相似,则在P的晶胞中包含_____个B,_____个D,Q的结构和金刚石相似,晶胞边长为361.5pm,则Q的密度是_______g·cm-3(只要求列算式,不必计算出数值,阿伏伽德罗常数为NA)。
(9分)“在火星上找到水存在的证据”位居《Science》杂志评出的2004年10大科技突破之首,由此火星问题引发了科学家的极大关注,也引起了广大群众的兴趣。
(1)火星大气中二氧化碳占95.23%(体积分数),氧气约占0.13%,岩层中含有较丰富的镁资源。如果让火星上的镁单质燃烧,可以作为未来火星的燃料,则发生的主要反应的化学方程式为:。
(2)2004年,美国科学家通过“勇气”号太空车探测出火星大气中含有一种称为硫化羰的物质,已知硫化羰分子式为COS,与二氧化碳的结构相似,但能在氧气中完全燃烧。硫化羰的电子式;中心元素采取的杂化方式为_________;硫化羰在氧气中完全燃烧的化学方程式为。
(3)“机遇号”火星车发回来的信息经检测,火星上有针铁矿[FeO(OH)]和黄钾铁矾,黄钾铁矾的化学式为KFe3(SO4)2(OH)6 ,从而证明火星表面曾经存在过水。两种铁的化合物中铁元素的化合价为,铁在周期表的位置是,铁的外围电子排布式。
下列曲线分别表示元素的某种性质与核电荷数的关系(Z为核电荷数,
Y为元素的有关性质);

A B C D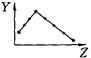



E F G H
把与下面的元素有关性质相符的曲线的标号填入相应括号中:
(1)ⅡA族元素的价电子数()(2)ⅦA族元素氢化物的沸点()
(3)第三周期元素单质的熔点()(4)第三周期元素的最高正化合价()
(5)IA族元素单质熔点()(6)F-、Na+、Mg2+、Al3+四种离子的离子半径()
(7)第三周期元素的第一电离能()(8)第二周期元素的电负性()