(9分)已知:① A是石油裂解气的主要成份,A的产量通常用来衡量一个国家的石油化工水平② 。现以A为主要原料合成乙酸乙酯,其合成路线如下图所示。
。现以A为主要原料合成乙酸乙酯,其合成路线如下图所示。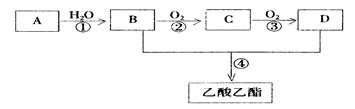
回答下列问题:
(1)B、D分子中的官能团名称分别是 、 。
(2)写出下列反应的反应类型:① ,② ,④ 。
(3)写出下列反应的化学方程式:
② ;④ 。
现有镁条、铝粉、铜片、氧化铝、氧化铁、氯酸钾及其它常用的实验用品和仪器,根据现有药品,请你设计简单实验验证铝、铁金属单质的还原性强弱。依据你设计的实验方案,回答下列问题:
(1)实验原理:(用化学方程式表示);实验中所需的化学仪器为。
(2)引发实验的操作方法为:。
(3)实验探究:取少量反应所得到的固体混合物,将其溶于足量稀H2SO4,滴加KSCN溶液无明显现象,(填能或否)说明固体混合物中无Fe2O3,并说明理由(理由用离子方程式说明)。
根据下图回答问题: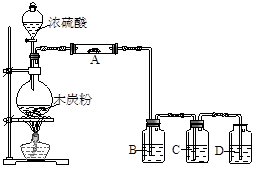
(1)上述装置中,在反应前用手掌紧贴烧瓶外壁检查装置的气密性,观察不到明显的现象,可以用一种简单的方法证明该装置不漏气,其方法和现象是证明该装置不漏气。
(2)烧瓶中发生反应的化学方程式为:。
(3)欲用图中的装置检验上述反应的全部产物。①仪器A要检验产物中的水,则A中的固体是;②B中装入品红溶液,目的是检验;③D中装入澄清石灰水以检验产物中的CO2,要使其它气体不干扰D中CO2的检验,则C中应装入的溶液是。
某化学小组采用类似制乙酸乙酯的装置(如图),以环己醇制备环己烯。
已知: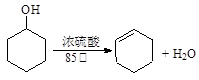 ;
;
反应物和生成物的物理性质如下表:
| 密度(g/cm3) |
熔点(℃) |
沸点(℃) |
溶解性 |
|
| 环已醇 |
0.96 |
25 |
161 |
能溶于水 |
| 环已烯 |
0.81 |
-103 |
83 |
难溶于水 |
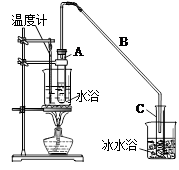
制备粗品:将12.5mL环己醇加入试管A中,再加入lmL浓硫酸,摇匀后放入碎瓷片,缓慢加热至反应完全,在试管C内得到环己烯粗品。
①A中碎瓷片的作用是,导管B除了导气外还具有的作用是。
②试管C置于冰水浴中的目的是 。
(2)制备精品
①环己烯粗品中含有环己醇和少量酸性杂质等。加入
饱和食盐水,振荡、静置、分层,环己烯在层(填上
或下),分液后用(填序号)洗涤:
a.KMnO4溶液 b.稀H2SO4 c.Na2CO3溶液
②再将环己烯按下图装置蒸馏,冷却水从(填字母)口进入;蒸馏时要加入生石灰的目的。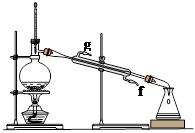
③上图蒸馏装置收集产品时,控制的温度应在左右,实验制得的环己烯精品质量低于理论产量,可能的原因是:a.蒸馏时从70℃开始收集产品;b.环己醇实际用量多了;c.制备粗品时环己醇随产品一起蒸出;d.是可逆反应,反应物不能全部转化
(3)区分环己烯精品和粗品(是否含有反应物)的方法是。
实验室可以用如下方法制取少量单质溴:
2NaBr+MnO2+2H2SO4 Na2SO4+MnSO4+Br2↑+2H2O
Na2SO4+MnSO4+Br2↑+2H2O
根据左图实验装置,填空和回答问题: 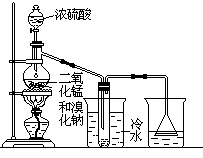
(1)装置(Ⅰ)的烧杯中冷水所起的作用是______ ,装置(Ⅱ)的烧杯中液体的作用是 ______________。
(2)进行此实验时,烧瓶内的橡皮塞最好用锡箔包住,用橡皮管连接的两玻璃管口要相互紧靠,这是因为 ____________________________。
(3)装置(Ⅱ)烧杯中使用倒置漏斗可防止液体倒吸,试简述其原因
________________________________________________________。
实验室需要制备纯净的氯化钾晶体。现有含少量KBr和K2SO4的氯化钾样品,按照下图所示的实验方案进行提纯。
(1)操作I的名称,操作Ⅱ所需的玻璃仪器有酒精灯和。
(2)若用硝酸钡来代替氯化钡,是否可行?请说明理由。
。
(3)若实验所得固体甲、乙的质量分别为W1g和W2g,则样品中KBr的质量分数计算式为。
(4)某同学对该实验方案提出质疑,他认为加适量氯化钡溶液不容易控制,应加入过量氯化钡溶液,请你按他的思路,写出实验流程图中所用试剂、所得产物的化学式和相应操作的名称,A,B,滤液C,操作Ⅱ。