金属铜的提炼多从黄铜矿开始.黄铜矿的焙烧过程中主要反应之一的化学方程式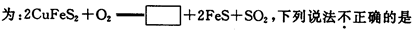
| A.方框中的物质应为 Cu2S | B.若有1 molSO2 生成,则反应中有4 mol 电子转移 |
| C.SO2既是氧化产物又是还原产物 | D.O2只作氧化剂 |
已知同周期X、Y、Z三种元素的最高价氧化物对应水化物酸性由强到弱的顺序为:HXO4>H2YO4>H3ZO4,则下列判断正确的是
| A.元素非金属性按X、Y、Z的顺序减弱 |
| B.阴离子的还原性按X、Y、Z的顺序减弱 |
| C.气态氢化物的稳定性按X、Y、Z的顺序增强 |
| D.单质的氧化性按X、Y、Z的顺序增强 |
某主族元素R的最高正价与最低负化合价的代数和为4,由此可以判断
| A.R一定是第四周期元素 |
| B.R的气态氢化物比同周期其他元素气态氢化物稳定 |
| C.R一定是ⅣA族元素 |
| D.R气态氢化物化学式为H2R |
氢氧燃料电池是一种高效、环境友好的发电装置,它是以铂作电极,KOH溶液作电解液,总反应为:2H2 + O2 = 2H2O,正极反应为:O2 + 2H2O + 4e- = 4OH-,下列叙述不正确的是
| A.H2通入负极区 | B.O2通入正极 |
| C.正极发生氧化反应 | D.负极反应为2H2 + 4OH- - 4e- = 4H2O |
可逆反应 2A (气) + 3B (气)  2C (气) + D(气),在四种不同条件下反应速率最快的是
2C (气) + D(气),在四种不同条件下反应速率最快的是
| A.VA = 0.5mol/(L·min) | B.VB = 0.6mol/(L·min) |
| C.VC = 0.35mol/(L·min) | D.VD = 0.4mol/(L·min) |
过量的锌粉与一定量的稀盐酸反应,为了减慢反应速率,但是又不影响生成的氢气总量,可以采取的措施是
| A.升高温度 | B.加入适量的水 | C.加入少量CuSO4溶液 | D.加入浓度较大的盐酸 |