相同温度,相同物质的量浓度的四种溶液:① CH3COONa ② NaHSO4 ③ NaCl ④ C6H5-ONa ⑤NaHCO3 ⑥Na2CO3,按pH由大到小的顺序排列,正确的是
| A.⑥>⑤>④>①>③>② | B.⑥>④>⑤>①>③>② |
| C.⑥>④>⑤>①>②>③ | D.⑥>⑤>④>①>③>② |
已知相同条件下HF的电离程度大于CH3COOH。同温度下对于同浓度、同体积的CH3COONa溶液和NaF溶液,下列说法正确的是
| A.CH3COONa溶液中存在的离子只有:CH3COO-、Na+ |
| B.在形成CH3COONa溶液的过程中,存在着多个电离、水解过程,其中以CH3COO-的水解过程为主 |
| C.HF的电离程度大,意味着NaF溶液中,F-对水的电离平衡的促进作用小 |
| D.CH3COONa溶液的pH大于NaF溶液的pH, 这是由于CH3COOH电离出的c(H+)更小造成的 |
实验室制取甲酸乙酯的反应为: HCOOH+CH3CH2OH HCOOCH2CH3+H2O
HCOOCH2CH3+H2O
反应在该条件下进行时各物质的浓度(mol・L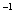 )随时间的变化如下表:
)随时间的变化如下表:
| 时间(min) |
HCOOH |
CH3CH2OH |
HCOOCH2CH3 |
H2O |
| 0 |
0.3 |
0.7 |
0 |
0.3 |
| 10 |
0.23 |
a |
b |
c |
| 20 |
0.2 |
0.6 |
0.1 |
0.4 |
有关物质在101.3KPa时沸点如下:
| HCOOH |
CH3CH2OH |
HCOOCH2CH3 |
H2O |
|
| 沸点(℃) |
101 |
78.5 |
54 |
100 |
该反应的化学平衡常数表达为K=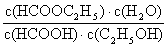 ;有关下列叙述不正确的是
;有关下列叙述不正确的是
A.由题给条件不能判断出K值随温度变化是增大还是减小
B.表中a应该等于0.63 mol・L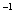
C.已知50℃下,K=1/3,可由此判断出20min时反应还未达到平衡
D.在起始浓度相同的情况下,要提高产率可采取的措施是适当升高温度将甲酸乙酯蒸出
下列各组物质之间通过一步就能实现如图所示转化的是
| 选项 |
物质转化关系 |
甲 |
乙 |
丙 |
丁 |
| A |
 |
Al2O3 |
NaAlO2 |
Al |
Al(OH)3 |
| B |
Na2O |
Na2O2 |
Na |
NaOH |
|
| C |
CH2=CH2 |
CH3CH2OH |
CH3CHO |
CH3COOH |
|
| D |
NO |
NO2 |
N2 |
HNO3 |
某温度时,N2与H2反应过程中的能量变化如图所示。下列叙述正确的是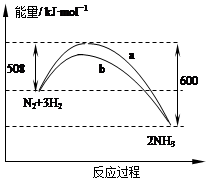
| A.a曲线是加入催化剂时的能量变化曲线 |
| B.在密闭容器中加入1 mol N2、3 mol H2,充分反应放出的热量小于92 kJ |
| C.由图可知,断开1mol 氮氮三键与1 mol 氢氢键吸收的能量和小于形成1mol 氮氢键所放出的能量 |
| D.反应物的总能量低于生成物的能量 |
短周期元素R、W、X、Y、Z的原子序数依次增大,R原子的最外层电子数是其内层电子数的2倍,X元素的焰色反应呈黄色,W元素和Z元素同主族,且Z元素的核电荷数是W的2倍,Y是地壳中除氧外含量最多的非金属元素。下列说法不正确的是
| A.W与X形成的两种化合物中阴、阳离子的个数比均为1∶2 |
| B.Y、R、Z最高价氧化物对应水化物的酸性强弱顺序:Z>R>Y |
| C.W的氢化物稳定性比Z的氢化物稳定性低 |
| D.Y与W形成的化合物YW2的熔点高、硬度大 |