如图是某分子的比例模型,黑色的是碳原子,白色的是氢原子,灰色的是氧原子。该分子是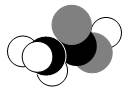
| A.C2H5OH | B.CH3COOH |
| C.CH3CHO | D.C6H5OH |
从下列事实,不能用勒夏特列原理解释的是( )
A.在溴水中存在如下平衡:Br2+H2O  HBr+HBrO当加入NaOH溶液后颜色变浅 HBr+HBrO当加入NaOH溶液后颜色变浅 |
B.对   平衡体系增加压强使颜色变深 平衡体系增加压强使颜色变深 |
C.反应  CO2+NO△H<0升高温度使平衡向逆方向移动 CO2+NO△H<0升高温度使平衡向逆方向移动 |
D.合成氨反应: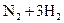   ,△H<0 为使氨的产率提高,理论上应采取低温高压的措施 ,△H<0 为使氨的产率提高,理论上应采取低温高压的措施 |
密闭容器中,反应2X(g) Y(g)+Z(s)已达到平衡,下列叙述正确的是()
Y(g)+Z(s)已达到平衡,下列叙述正确的是()
| A.若升高温度,X(g)的浓度增大,则正反应为吸热反应 |
| B.若容器体积不变,在平衡混合物中加入少量Z(s),则平衡向左移动 |
| C.压强变化对该平衡没有影响 |
| D.若容器体积不变,加入氦气平衡不移动 |
14CO2与碳在高温条件下发生反应:14CO2+C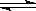 2CO,达到化学平衡后,平衡混合物中含14C的微粒有()
2CO,达到化学平衡后,平衡混合物中含14C的微粒有()
| A.14CO2 | B.14CO2、14CO | C.14CO2、14CO、14C | D.14CO |
已知NO2和N2O4可以相互转化:N2O4(g) 2NO2(g)△H <0。在恒温条件下将一定量NO2和N2O4的混合气体通入一容积为2 L的密闭容器中,反应物浓度随时间变化关系如下图。下列说法不正确的是
2NO2(g)△H <0。在恒温条件下将一定量NO2和N2O4的混合气体通入一容积为2 L的密闭容器中,反应物浓度随时间变化关系如下图。下列说法不正确的是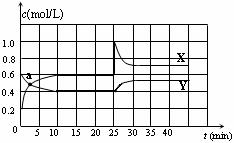
| A.图中的两条曲线,X是表示NO2浓度随时间的变化曲线 |
| B.a点时v(N2O4) = v(NO2) |
| C.25 min时改变了影响速率的一个因素,使得NO2转变为N2O4,该改变是将密闭容器的体积缩小,增大压强 |
| D.前10 min内用v(N2O4)表示的化学反应速率为0.02 mol/(L·min) |
下图所示的直型石英玻璃封管中充有CO气体,左端放置不纯的镍(Ni)粉。在一定条件下,Ni可以与CO(g)发生如下反应: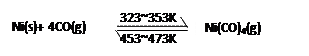

但Ni粉中的杂质不与CO(g)发生反应。玻璃管内左右两端的温度分别稳定在350K和470K,经过足够长时间后,下列说法正确的是
| A.在石英管右端主要物质是Ni(CO)4(g) |
| B.在石英管右端主要物质是纯Ni(s)和CO(g) |
| C.在石英管左端主要物质是纯Ni(s)和CO(g) |
| D.整个过程可以看作CO(g)将Ni(s)从石英管左端转移到右端,从而达到提纯目的 |