运用元素周期律分析下面的推断,其中错误的是
| A.铍(Be)是一种金属,它的氧化物的水化物可能具有两性 |
| B.砹是一种有色固体,HAt很不稳定,AgAt是有色难溶于水的固体 |
| C.硫酸锶(SrSO4)是难溶于水和盐酸的的白色固体 |
| D.硒化氢(H2Se)是无色、有毒、比H2S稳定的气体 |
常温下,浓度均为0.1 mol/L的6种盐溶液pH如下:
下列说法正确的是
| A.Cl2和Na2CO3按物质的量之比1:1反应的化学方程式为Cl2+Na2CO3+H2O=HClO+NaHCO3+NaCl |
| B.相同条件下电离程度比较:HCO3->HSO3->HClO |
| C.6种溶液中,Na2SiO3溶液中水的电离程度最小 |
| D.NaHSO3溶液中离子浓度大小顺序为c(Na+)>c(H+)>c(HSO3-)>c(SO32-)>c(OH-) |
向FeI2、FeBr2的混合溶液中通入适量氯气,溶液中某些离子的物质的量变化如图所示。已知: ==2Fe3++2Br-、2Fe3++2I-==2Fe2++I2,下列说法中错误的是
==2Fe3++2Br-、2Fe3++2I-==2Fe2++I2,下列说法中错误的是
| A.还原性:I->Fe2+>Br- |
| B.线段AB表示Fe2+被氯气氧化 |
| C.线段BC表示生成4 mol Fe3+ |
D.原溶液中n ( )="6" mol )="6" mol |
将下图所示实验装置的K闭合,下列判断正确的是
| A.Cu电极上发生还原反应 |
B.电子沿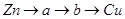 路径流动 路径流动 |
C.片刻后甲池中 增大 增大 |
| D.片刻后可观察到滤纸b点变红色 |
水溶液X中只可能溶有K+、Mg2+、Al3+、[Al(OH)4]-、SiO32-、CO32-、SO32-、SO42-中的若干种离子。某同学对该溶液进行了如下实验:下列判断正确的是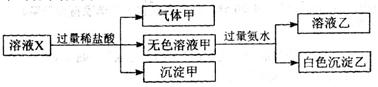
| A.气体甲一定是纯净物 |
| B.沉淀甲是硅酸和硅酸镁的混合物 |
| C.K+、Al(OH)4-和SiO32-一定存在于溶液X中 |
| D.CO32-和SO42-一定不存在于溶液X中 |
下列实验操作与预期实验目的或所得实验结论一致的是
| 选项 |
实验操作 |
实验目的或结论 |
| A |
向含有少量FeCl3的MgCl2溶液中加入足量Mg(OH)2粉末,搅拌一段时间后过滤 |
除去MgCl2溶液中少量FeCl3 |
| B |
向某溶液中加入BaCl2溶液生成白色沉淀,继续加稀硝酸沉淀不消失 |
证明溶液中含有SO42- |
| C |
向某溶液中加入稀盐酸,放出无色无味气体,将气体通入澄清石灰水 ,石灰水变浑浊 |
证明该溶液中存在CO32- |
| D |
向0.1mol•L-1FeSO4溶液中滴加少量酸性KMnO4溶液,KMnO4溶液褪色 |
说明Fe2+具有氧化性 |