下列说法不正确的是
| A.在共价化合物中一定含有共价键 |
| B.含有离子键的化合物一定是离子化合物 |
| C.含有共价键的化合物一定是共价化合物 |
| D.化学反应过程中,反应物分子内的化学键断裂,产物分子的化合键形成 |
在一定温度条件下,对于已达到平衡的反应:
FeCl3 +3KSCN 3KCl+Fe(SCN)3,在此溶液中作如下处理,平衡左移的是
3KCl+Fe(SCN)3,在此溶液中作如下处理,平衡左移的是
| A.加入少量氯化钾固体 | B.加入少量氯化铁固体 |
| C.减少Fe(SCN)3的浓度 | D.加水稀释 |
盖斯定律认为:不管化学过程是一步或分为数步完成,这个过程的热效应是相同的。
已知:H2O(g)= H2O(l)△H1 =-Q1 kJ·mol-1(Q1>0)
C2H5OH(g)= C2H5OH(l)△H2 =-Q2 kJ·mol-1(Q2>0)
C2H5OH(g)+3O2(g)=2CO2(g)+3H2O(g) △H3 = -Q3 kJ·mol-1(Q3>0)若使23g液态乙醇完全燃烧,最后恢复到室温,则放出的热量为(kJ)
| A.Q1+ Q2+Q3 | B.0.5(Q1+Q2+Q3 ) |
| C.0.5 Q1-1.5 Q2+0.5Q3 | D.1.5 Q1-0.5 Q2+0.5Q3 |
下列说法或表示方法正确的是
| A.若将等量的硫蒸气和硫固体分别完全燃烧,后者放出热量多 |
| B.由“C(石墨)=C(金刚石) ΔH=1.9kJ/mol”可知,金刚石比石墨稳定 |
| C.在稀溶液中:H+(aq)+OH-(aq)=H2O(l) ΔH=-57.3kJ/mol,若将含1molCH3COOH与含1mol NaOH的溶液混合,放出的热量小于57.3kJ |
| D.在101kPa时,2gH2完全燃烧生成液态水,放出285.8kJ热量,氢气燃烧的热化学方程式表示为:2H2(g)+O2(g)=2H2O(l) ΔH=—285.8kJ/mol |
下列表述中正确的是
| A.任何能使熵值增大的过程都能自发进行 |
| B.△H<0,△S>0的化学反应一定能自发进行 |
C.已知热化学方程式2SO2(g)+O2(g) 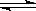 2SO3(g)△H=-QkJ·mol-1(Q>0),则将2mol SO2(g) 和1mol O2(g) 置于一密闭容器中充分反应后放出Q kJ的热量 2SO3(g)△H=-QkJ·mol-1(Q>0),则将2mol SO2(g) 和1mol O2(g) 置于一密闭容器中充分反应后放出Q kJ的热量 |
| D.稀溶液中1mol NaOH分别和1mol CH3COOH、1molHNO3反应,两者放出的热量一样多 |
用下图所示装置检验乙烯时不需要除杂的是()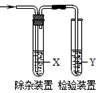
| 乙烯的制备 |
试剂X |
试剂Y |
|
| A |
CH3CH2Br与NaOH乙醇溶液共热 |
水 |
Br2的CCl4溶液 |
| B |
CH3CH2Br与NaOH乙醇溶液共热 |
水 |
KMnO4酸性溶液 |
| C |
C2H5OH与浓H2SO4 |
NaOH溶液 |
KMnO4酸性溶液 |
| D |
C2H5OH与浓H2SO4 |
NaOH溶液 |
Br2的CCl4溶液 |