(3分)下图表示4个碳原子相互结合的方式。小球表示碳原子,小棍表示化学键,假如碳原子上其余的化学键都是与氢结合。
(1)图中属于烷烃的是 (填编号)属于烯烃的是 ,(填编号)
(2)上图中与B互为同分异构体但不属于同种类的物质的是: 。(填编号)
在t℃时,某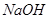 稀溶液中,
稀溶液中,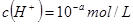 ,
,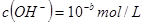 ,已知
,已知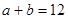 ,则:
,则:
(1)该温度下,水的离子积常数Kw=__________________。
(2)在该温度下,将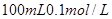 的稀硫酸与
的稀硫酸与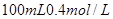 的
的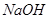 溶液混合后,溶液的pH=_________,此时该溶液中由水电离的
溶液混合后,溶液的pH=_________,此时该溶液中由水电离的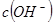 =_________。
=_________。
(3)该温度下,若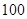 体积
体积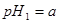 的某强酸溶液与1体积
的某强酸溶液与1体积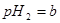 的某强碱溶液混合后溶液呈中性,则混合前,该强酸的
的某强碱溶液混合后溶液呈中性,则混合前,该强酸的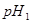 与强碱的
与强碱的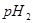 之间应满足的关系是_________。
之间应满足的关系是_________。
(4)该温度下,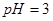 的硫酸溶液和
的硫酸溶液和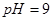 的
的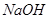 溶液等体积混合后,混合溶液的
溶液等体积混合后,混合溶液的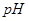 _________(填>7、=7、<7);
_________(填>7、=7、<7);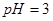 的醋酸溶液和
的醋酸溶液和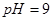 的
的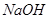 溶液等体积混合后,混合溶液的
溶液等体积混合后,混合溶液的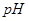 _________(填>7、=7、<7)。
_________(填>7、=7、<7)。
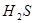 溶于水的电离方程式为___________________________。
溶于水的电离方程式为___________________________。
(1)向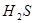 溶液中加入浓盐酸时,电离平衡向_________移动,
溶液中加入浓盐酸时,电离平衡向_________移动,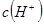 _________(填增大、减小、不变),
_________(填增大、减小、不变),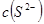 _________(填增大、减小、不变)。
_________(填增大、减小、不变)。
(2)向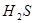 溶液中加入
溶液中加入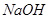 固体,电离平衡向_________移动,
固体,电离平衡向_________移动,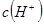 _________(填增大、减小、不变),
_________(填增大、减小、不变),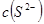 _________(填增大、减小、不变)。
_________(填增大、减小、不变)。
(3)若要使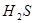 溶液中
溶液中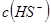 增大,且使
增大,且使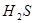 的电离平衡逆向移动,可以加入_________。
的电离平衡逆向移动,可以加入_________。
(4)向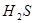 溶液中加水,
溶液中加水,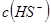 _________(填增大、减小、不变),溶液
_________(填增大、减小、不变),溶液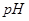 _________(填增大、减小、不变)
_________(填增大、减小、不变)
用实验确定某酸HA是弱电解质,两同学的方案是:
甲:①称取一定质量的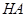 配制
配制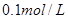 的溶液
的溶液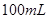 ;
;
②用pH试纸测出该溶液的pH,即可证明HA是弱电解质。
乙:①用已知物质的量浓度的HA溶液、盐酸,分别配制pH=1的两种酸溶液各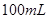 ;
;
②分别取这两种溶液各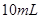 ,加水稀释为
,加水稀释为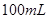 ;
;
③各取相同体积的两种稀释液装入两个试管,同时加入纯度相同的锌粒,观察现象,即可证明HA是弱电解质。
(1)在两个方案的第①步中,都要用到的定量仪器是_________。
(2)甲方案中,说明HA是弱电解质的理由是测得溶液的pH_______1(选填>、<、=)
乙方案中,说明HA是弱电解质的现象是_________(多选扣分)
(a)装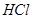 溶液的试管中放出
溶液的试管中放出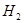 的速率快;
的速率快;
(b)装HA溶液的试管中放出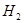 的速率快;
的速率快;
(c)两个试管中产生气体速率一样快。
(3)请你再提出一个合理且比较容易进行的方案(药品可任取),作简明扼要表述____________________________________。
在一定条件下,反应

 达到平衡:
达到平衡:
(1)若A、B、C均为气体,则该反应的平衡常数表达式为________;
(2)若A、B、C均为气体,减压后平衡向逆反应方向移动,则 、y、z间的关系是________________;
、y、z间的关系是________________;
(3)若已知C是气体,且 ,在增大压强时,若平衡发生移动,则一定向________(填“正”或“逆”)反应方向移动;
,在增大压强时,若平衡发生移动,则一定向________(填“正”或“逆”)反应方向移动;
(4)已知B、C是气体,当其他条件不变时,增大A的物质的量,平衡不移动,则A为________态;
(5)加热后C的质量分数减少,则正反应是________(填“放热”或“吸热”)反应。升高温度达到新的平衡后,该反应的平衡常数将变________(填“大”或“小”)
常温下,现有一瓶稀氨水、标准盐酸、pH试纸、必要的酸碱指示剂等药品,要测定 电离度
电离度 的数值,其实验方案可设计如下:
的数值,其实验方案可设计如下:
(1)先测稀氨水的__________,设其数值为a,可通过__________实验(写名称,不用写过程)实现此目的。
(2)再测定其pH,设其数值为b,其操作过程简述如下:__________
(3)用a、b表示该氨水的电离度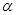 __________。
__________。